Objetivos
Al finalizar la
lectura de este artículo, el lector podrá:
1. El estudiante aprenderá la epidemiologia e incidencia de la apendicitis aguda así como
su influencia en el diagnóstico y pronóstico.
2. Conocer,
comprender y analizar la etiología de la apendicitis aguda diferenciando causas por edad , sexo y su
relación con el pronóstico.
3. El estudiante Aprenderá la fisiopatología de la apendicitis aguda y su
relación con la sintomatología y
pronóstico.
4. El Estudiante conocerá, identificara y
diferenciara la Anatomía patológica de
en cualquiera de sus fases fisiopatológicas
5. El estudiante aprenderá las clasificaciones más representativas y reconocidas de la así como su relación fisiopatológica y
tratamiento quirúrgico
Mapa conceptual
Definiciones
Apendicitis
Aguda: Infiltración de leucocitos
a la membrana basal en el apéndice cecal.
Apendicitis
no complicada: Apendicitis
aguda sin datos de perforación.
Apendicitis
complicada: Apendicitis aguda perforada
con y sin absceso localizado y/o peritonitis purulenta.
Apendicectomía
Convencional: Técnica
quirúrgica tradicional (abierta).
Apendicectomía
laparoscópica: Cirugía de
mínima invasión. (GPC, 2014)
Historia
La apendicitis (AP), como causa de abdomen agudo
inflamatorio, es tan antigua como el mismo origen del hombre. En
momias egipcias de la era Bizantina se observaron adhesiones en el cuadrante
inferior derecho, sugestivas de AP antiguas (Williams,
1983. Seal,
1981).
El apéndice cecal no fue muy
frecuentemente mencionado en muchos estudios anatómicos antiguos, probablemente
debido a que estos estudios fueron realizados en especies animales los cuales
no poseen éste órgano.
El apéndice estuvo evidentemente
representado en dibujos anatómicos de Leonardo da
Vinci, hechos en 1492, dibujó
una figura humana donde se observa el colon y el
apéndice cecal, al que denominó “orecha” en italiano y que significa “ear”,
“oreja”, tal
vez quiso decir apéndice. Pero
no fueron publicados sino hasta el siglo XVI y sirvieron de ilustración para el
trabajo de Andreas Vesalius “De Humani Corporis Fabrica”, publicado en el año de 1543, aunque
éste no fue descrito en el texto (Osorio,
1992).
Figura 1. Un dibujo
de Leonardo da Vinci de 1492 representa muy claramente un apéndice latero cecal
interno.
En el año 1524,
Capri y en 1543, Vesalio describen el apéndice como tal. Los
primeros conocimientos sobre el apéndice cecal fueron referidos por los
anatomistas Carpi y Estienne en el siglo XVI, asombrados por el descubrimiento
que hicieron en una de las muy pocas autopsias realizadas en aquellos tiempos. (Bett,
1934).
Algunos historiadores de la
apendicitis acreditan a Jean Fernel,
médico de la corte de Catherine de Medici, el
haber realizado la primera publicación en el año de 1544, en la autopsia de una niña de
siete años. Múltiples casos de apendicitis fueron hallados en autopsias
posteriores.
En 1710
Verheyen la llama por primera vez apéndice vermiforme. Vidus Vidius, designa un
hallazgo similar con el nombre de "apéndice vermiforme" por su
similitud con un gusano.
Si bien se ha adjudicado su descripción a Jean Fernel y Von Hilden, fue
Lorenz Heister (1683-1758) discípulo de Hermann Boerhaave (1668-1738) quien
describió una AP perforada con absceso en 1711. Heister, cirujano alemán
escribió el protocolo de una autopsia practicada en un reo ajusticiado en la
horca de Altdorf. Este autor
describió una autopsia realizada en el cadáver de un criminal que había sido
ejecutado y escribió: Cuando me
encontraba a punto de poner de manifiesto el intestino grueso, encontré el apéndice
vermiforme del ciego preternaturalmente negro. En el momento en que estaba por
separarlo, sus membranas se partieron y exhudaron dos o tres cucharadas de
materia. Es probable que esta persona pueda haber tenido algo de dolor en el
sitio. Indicando en su escrito que el apéndice se encontraba de color negro y
lleno de pus provocando supuraciones en el abdomen. Sin embargo la estructura
así descubierta y descrita no fue dado a conocer por los tratados de anatomía
hasta el decenio de 1739 - 1749, restando de esta manera importancia a los
hallazgos anteriores. En 1755, Heister comprendió que el apéndice
podía ser asiento de una inflamación aguda primaria. (Ellis, 1986).
Lorenz Heister
1711 Descripción inequívoca de un apéndice perforado con formación de absceso.
Giovanni
Battista Morgagni en 1719 Primera
descripción anatómica detallada del apéndice.
Si bien los
textos antiguos incluyen descripciones dispersas de operaciones practicadas por
dolencias parecidas a la apendicitis, el crédito de la ejecución de la primera
apendicectomía corresponde a Claudius Amyand, (1681-1740) un cirujano del St. George’s Hospital, de
Londres y adscrito al servicio de la reina Ana y los reyes Jorge I y II. (Barcat,
2010). La fecha sería 1736, Amyand
relató que el 8 de octubre de 1735 ingresó al St. George´s Hospital Hanvil
Anderson, un chico de 11 años, que desde la infancia tenía una hernia escrotal,
complicada con una fístula entre el escroto y el muslo que drenaba gran
cantidad de materia fecal y que para curarla era necesario curar la hernia. Lo
operó el siguiente 6 de diciembre. El tumor estaba compuesto en su mayor parte
por epiplón, tenía el tamaño de una manzana y en él se encontraba el apéndice
cecal perforado en la punta por un alfiler incrustado en una concreción
calcárea; por la perforación salía materia fecal cada vez que se movía el
alfiler adherido al epiplón. Alrededor, un absceso incluía el conducto
deferente y el testículo contenidos en el saco herniario. Amyand no sabía qué hacer
con el intestino perforado que reconoció, al final, como el apéndice cecal
"contraído, carnoso y duplicado". Tras una complicada disección,
extendida a la cavidad abdominal, resecó el epiplón, separó los vasos, el
deferente y el testículo y, de acuerdo a la opinión de los asustados
concurrentes, decidió amputar el anormal apéndice tras una ligadura en la base.
Retornó el intestino a la cavidad abdominal, dejó el resto de los elementos en
el saco escrotal y resecó la fístula. La incisión se mantuvo abierta con una
compresa. La operación duró casi media hora y fue "tan dolorosa para el paciente, como laboriosa para mí".
Al mes el chico fue dado de alta. La fístula curó, la hernia recidivó a los
seis meses (Barcat, 2010. Amyand, 1736. Antozzi, 1988. Bailey, 1959. Berne,
1999. Bett, 1934. Cueto, 1998. De Manzini, 1994. Ellis, 1986. Schwartz, 1995), Las
apendicitis dentro de las hernias no son tan infrecuentes, ocurriendo en
hernias inguinales (hernia de Amyand) y femorales (hernia de Garengeot).
En 1742, el cirujano francés Mestivier, drenó un absceso localizado
sobre la ingle derecha de un paciente sin sospechar su origen. Luego cuando el
paciente murió y al realizar su autopsia descubrió un apéndice purulento. El
cirujano no llegó a conclusión ni relación alguna con otros pacientes similares
y su informe a manera de hallazgo anecdótico no mereció atención de sus
contemporáneos siendo archivado.
En el año de 1759 el cirujano
parisino Meistivier
(Bailey, 1959), reportó una autopsia en un hombre
de 45 años, quien murió posteriormente al drenaje de un absceso en el cuadrante
inferior derecho.
John Hunter 1767 Describió un apéndice gangrenoso en una necropsia
Parkinson, en 1812 realizó la autopsia en un niño muerto después de
presentar dolor agudo abdominal, vómito intenso y fiebre alta. Encontró además
de una peritonitis generalizada el apéndice inflamado y perforado. Parkinson,
fue el primero en indicar una relación de causalidad entre la supuración del
apéndice y las peritonitis generalizadas pero sus conclusiones no despertaron
interés alguno y las personas seguían muriendo con el síndrome. La descripción
de un fecalito dentro de una AP perforada fue publicada por James
Parkinson en el año 1812.
El
siguiente siglo se dieron a conocer algunas observaciones esporádicas, sin que
ninguna de ellas sugiriera la relación
anatomoclínica entre el
apéndice y la
supuración de la fosa
ilíaca derecha.
En el año 1815, el Barón Dupuytren
fue el primero en abrir y drenar un absceso en la fosa ilíaca derecha y lo
consideró como consecuencia de una lesión cecal, creando el diagnóstico de
tiflitis y peritiflitis. El concepto de que los abscesos de la fosa ilíaca eran
originados por la inflamación del ciego y no del apéndice, y que su mejor
tratamiento era el drenaje entre el 5 y 12 día, continuó aceptándose hasta
fines de ese siglo.
En 1824, Loyer-Villermany
hizo una presentación en la Real Academia de Medicina de París, titulada
“Observaciones Utiles en los Cuadros Inflamatorios del Apéndice Cecal”, en la
cual describía dos ejemplos de apendicitis aguda que condujeron a la muerte. En
ambos casos, en la autopsia se encontró que el apéndice estaba negro y
gangrenoso, en tanto que había poco compromiso del ciego.
En 1827, François Melier, un
médico francés, expuso el trabajo de Louyer-Villermay. Comunicó seis casos de necropsia y fue el
primero que sugirió la identificación de apendicitis antes de la muerte. (Ellis,
1985) Este trabajo no lo consideraron importante muchos médicos de la
época, incluido el barón Guillaume Dupuytren.
Para complicar aún más la situación quirúrgica del apéndice, apareció el
criterio de Dupuytren, cirujano del Papa,
(Lindskog, 1977) que gozaba
de gran fama y credibilidad en el ámbito médico. Él había tenido la oportunidad
previa de drenar dos abscesos sobre la fosa íliaca derecha y como en ninguno de
ellos encontró el apéndice concentró su atención en la inflamación del ciego,
informando y divulgando que la supuración de la región se producía por la
inmovilidad de éste y que en el sitio de la válvula ileocecal existía un
estrechamiento donde se originaban "estancamientos e inflamaciones".
La posición de privilegio que ocupaba Dupuytren fue suficiente para que nadie
prestara atención a los estudios que señalaban al apéndice cecal y no al ciego
como causa de las supuraciones. Esta posición originó que el médico Pulchet y
su colaborador Goldbeck, bautizaran dicha enfermedad con el nombre de
"peritiflitis" el mismo que se impuso en todo el mundo escribiéndose
multitud de artículos sobre esta falsa dolencia que era más un efecto que
verdadera causa. Ellis,
1986 El término peritiflitis, apartó del verdadero camino quirúrgico a casi
dos generaciones de cirujanos. Se describieron gran cantidad de cuadros
clínicos y se inventaron denominaciones especiales. Los síntomas ligeros se
trataban con laxantes para "evitar el estancamiento" y en los graves
donde el 70% de los casos eran mortales se administraba opio para aliviar los
dolores y disminuir los movimientos peristálticos tratando de esta manera
conseguir tiempo para que las defensas naturales confinaran el proceso
supurado, que en el mejor de los casos serán absorbidos o abiertos al exterior
espontáneamente. El drenaje quirúrgico sólo se indicaba en aquellos raros casos
donde se manifestaba un absceso subcutáneo a punto de abrirse.
En el primer volumen del libro "Elementos de medicina
práctica" publicado en 1839, los doctores Richard Bright (1789-1858) y
Thomas Addison (1793-1860) del Guy´s Hospital, describieron la sintomatología
de la AP y establecieron que la AP provoca la mayoría de los procesos
inflamatorios de la fosa ilíaca derecha (Barcat, 2010, Lewis, 1987)
El tratamiento
quirúrgico no fue mencionado. En la literatura europea, Votz, en 1846, comenzó a
identificar al apéndice cecal como sitio de origen de la enfermedad
inflamatoria del cuadrante inferior derecho. Los términos “tiflitis” y “peritiflitis” continuaron en uso
hasta fines del siglo XIX.
El 25 de septiembre de 1848, Henry Hancock, cirujano londinense, de 39
años de edad presentó a la Real Sociedad Medica de Londres, el informe del caso
de una mujer de 30 años que padecía de agudos dolores en la fosa íliaca derecha
y cuyo diagnóstico, otorgado por los médicos del paciente, Chowne y Diamond era
de peritiflitis, los mismos que como era la costumbre le habían administrado
grandes cantidades de opio. Pero el 17 de abril, sabiendo Hancock que la muerte
podía sobrevenir en cualquier momento y que los drenajes sólo debían hacerse en
forma superficial, "Se armó del
valor característico que hace presa de los cirujanos en momentos de extrema
desesperación" y realizó el corte sobre una zona dura y profunda que
había palpado previamente, inmediatamente brotó gran cantidad de pus
aliviándose el paciente en forma notable a los pocos días. Con ese informe
Hancok se convirtió en el primer cirujano en emplear e indicar el bisturí aún
cuando el absceso esté localizado en situaciones profundas. Pero nuevamente sus
contemporáneos no dieron crédito a sus observaciones y continuó el dominio del
laxante y el opio, agravando y llevando a la muerte a los pacientes. Este autor escribió: Puede ser prematuro especular a partir del resultado de un solo caso,
pero yo confío en que llegará el momento en que este plan sea empleado con
éxito en otros casos de peritonitis que evolucionan hacia el derrame que, en
general, terminan fatalmente.
En 1856, las palabras de Hancock encontraron eco en Levis, quien volvió
a abrir un absceso profundo, sin embargo tuvo que transcurrir hasta 1874 antes
que Wilard Parker, se convirtiera en el tercer cirujano que drene abscesos
profundos de peritiflitis en forma sistemática. Parker de sesenta y cuatro años
de edad, profesor de la Universidad de Columbia y que gozaba de fama inició la
actividad quirúrgica encaminada a drenar abscesos de la región del ciego,
práctica que se fue imponiendo lentamente. Sin embargo, con este nuevo avance,
poco mejoró en general la morbi-mortalidad porque la operación se realizaba en
aquellos pacientes extremadamente graves.
En este momento histórico, parece ser que la totalidad de los cirujanos
estuvieran cegados al no ver al apéndice vermiforme como el verdadero causante
del mal pero tanto en Francia como en Alemania existían cirujanos como Kless,
Bamberger, Leudet, Wirth, Bierhoff que abordaron el tema correctamente aún
escribiendo sobre él pero sus notas no fueron decisivas frente a la generalidad
del pensamiento quirúrgico en el mundo.
Fue hasta 1880 cuando se hizo la
primera apendicectomía transabdominal por parte de Lawson Tait, en Londres, en
la cual se extirpó un apéndice gangrenoso
a una muchacha de 17 años de edad. La paciente se
recuperó. Desde el punto de vista de
la prioridad, Shepherd demostró, en 1880, que Tait, de Birmingham, Inglatérra,
operó a un paciente con apendicitis gangrenosa, extirpó el apéndice y se
produjo su recuperación. Sin embargo, Tait no registró este caso hasta 1890. (Bernhard,
1980)
La aceptación de la apendicectomía
como tratamiento fue ejecutado en 1883 por Abraham Groves de Fergus Ontario. El 10 de mayo de 1883, él
observó a un muchacho de 12 de años de edad, con dolor e hiperestesia en el
cuadrante inferior derecho; Groves aconsejó
realizar una intervención quirúrgica para remover el apéndice inflamado. El
muchacho se recuperó. Aunque Groves escribió
varios artículos científicos, él no reportó este caso sino hasta cuando lo
mencionó en su autobiografía publicada en 1934 (Harris, 1961).
Fergus, en Canadá, efectuó la
primera apendicectomía electiva en 1883. (Ellis, 1985)
Un acceso extraperitoneal del
apéndice con remoción externa de un fecalito es establecido (incorrectamente)
como la primera apendicectomía para apendicitis aguda realizada por R. J. Hall en el año de 1886 (Ellis,
1986).
El crédito de la primera publicación de una
apendicectomía debe ser adjudicado a Kronlein en 1886, aunque el paciente, de
17 años, murió dos días más tarde.
En junio de 1886 se realizó el congreso de la Asociación Americana de Médicos en Washington, DC. Muchos líderes de la medicina americana estuvieron presentes, como Sternberg, Prudden, Osler y otros. El Dr. Reginald H. Fitz profesor de medicina en la Escuela de Harvard presentó su conferencia titulada "Perforating infammation of the vermiform appendix; with special reference to its early diagnosis and treatment". (inflamación perforante del apéndice vermicular: con referencia especial a su diagnóstico y tratamiento tempranos).
En este
Sir
Frederick Treves, cirujano, escritor e historiador inglés, contribuyó a la
difusión de las ideas de Fitz. Su influyente conferencia "Relapsing
tyflitis treated by operation", cuyo texto recibió la Royal Medical
and Chirurgical Society en septiembre de 1887, se leyó en febrero de 1888 y se
publicó en el mismo año.
El 27 de abril de 1887, Morton (Filadelfia)
realiza la primera apendicectomía verdadera (ablación de un apéndice perforado
con ligadura de la base apendicular y del meso). El paciente sanó.
En 1889 salió a la luz en el New
York Medical Journal su notable artículo en el que señalaba las
indicaciones de una laparotomía temprana para el tratamiento de la apendicitis.
En este trabajo se refirió al punto de McBurney como el sitio de
“hipersensibilidad máxima cuando se examina con las puntas de los dedos, que se
encuentra en adultos 1.25 a 5 cm adentro de la apófisis espinosa anterior
derecha del iliaco en una línea trazada de ese punto hasta el ombligo”. Desde
entonces se denominó “punto de McBurney” al lugar de mayor sensibilidad a la
palpación del abdomen en el caso de apendicitis. El dolor a la palpación en ese
punto, situado en la unión del tercio externo con el tercio medio de una línea
imaginaria que uniera la espina iliaca anterosuperior con el ombligo. De forma subsecuente, McBurney notificó en
1894 la incisión que lleva su nombre. Empero, más adelante el propio McBurney
acreditó a McArthur la primera descripción de esta incisión. En 1889, Chester McBurney describió el dolor
migratorio caracteristico y la localizacion del mismo sobre una linea oblicua
que iba desde la espina iliaca anterosuperior hasta el ombligo.
John Benjamin Murphy (1857-1916) en 1889, realizó la primera cirugía
temprana para prevenir las complicaciones de la apendicitis. (Williams,
1983). El cuadro clínico inicial de la apendicitis aguda se presenta por
lo general, ordenado y cronológico, según se describe en la triada sintomática
de Murphy. Esta no es patognomónica de la apendicitis ya que se puede observar
en la pancreatitis y la úlcera perforada. Está constituida por dolor
epigástrico o peri umbilical, que es un síntoma capital, casi siempre llamativo
y alarmante, seguido de anorexia, náuseas o vómitos; el dolor se irradia y se
localiza en la fosa ilíaca derecha, a esto se le puede agregar fiebre y
leucocitosis, si esto último ocurre, se la llama péntada de Murphy. Se presenta
aproximadamente en 60% de los pacientes. El dolor provocado al descomprimir
bruscamente la fosa iliaca derecha se denomina signo de Blumberg en honor a su
descubridor Jacob Moritz Blumberg (1873-1955), y si es generalizado se llama
signo de Noël Guéneau de Mussy (1813-1885).
Ante estos singulares éxitos de la extirpación apendicular, nadie
pensaba todavía en el criterio de la cirugía preventiva, la misma que
preconizaba la intervención durante los primeros síntomas y así prevenir la
supuración y la perforación. La defensa de esta modalidad fue realizada con
singular fanatismo por John Benjamin Murphy, de 32 años y que ejercía en
Chicago. Es gracias a este cirujano que aún en nuestros días la extirpación
precoz y radical del apéndice inflamado en forma muy temprana es una intervención
natural.
También ocurrió que en 1897, el francés Mellier colecciona una de las
primeras series de abscesos de la región del ciego indicando que su causa es la
inflamación del apéndice vermicular y aún llega a profetizar que algún día
dicho órgano se cortará con el bisturí, pero tampoco sus informes despertaron
interés entre los cirujanos de la época.
En 1902
se le drena a Eduardo VII (Inglaterra) con éxito quirúrgico.
La recomendación de la
apendicectomía incidental en cirugía ginecológica y obstétrica fue efectuada
por Fischer en 1909 y por Goldsphon en 1911. (Thompson,
1993).
La primera apendicectomía incidental
durante cirugía vaginal fue reportada en 1949 por Bueno en España, quien comunicó tres casos de apendicectomía
incidental en el momento de una histerectomía vaginal.
La técnica operatoria usada para la
apendicectomía nunca estuvo completamente estandarizada. Incisiones verticales
en la línea media en casos más tempranos fueron utilizadas, pero la exposición
no era la adecuada (Mcade, 1964). La incisión descrita por William Henry Battle del Saint Thomas
Hospital de Londres en 1897 era una incisión vertical lateral a través
del borde de la vaina del recto derecho. Debido a ello la denervación del
músculo recto abdominal fue común. La incisión muscular lateral o “en parrilla”
fue generalmente mencionada como la incisión McBurney, la cual fue usada simultáneamente por el Doctor Lewis L. McArthur de Chicago y
presentada en la Sociedad Médica de Chicago en junio de 1894. La descripción de
McBurney fue descrita en el Annals of Surgery en julio de 1894, vol.
20:38-43. Si bien McBurney concedió
prioridad a la incisión de McArthur,
el uso del término “incisión de
McBurney” continuó en uso. (Brooks, 1959). Fue J. W. Elliot de Boston quien el año de
1896 describió la incisión transversa de la piel. (Mcade, 1964). En
1905 A. E. Rockey de Pórtland Oregon,
es a quien comienza a adjudicarse la incisión transversa para las
intervenciones quirúrgicas de la parte baja del abdomen. Rockey describe la división vertical
de la capa muscular y no hace mención a la divulsión muscular. Un año después, Gwilym G. Davis de Filadelfia, también
se adjudica la incisión transversa en la piel, pero divide la porción lateral
de la vaina de los rectos y la extiende lateralmente por corte del oblicuo
externo y divulsión del oblicuo interno en dirección transversal de sus fibras.
Ninguno de ellos: Rokey ni Davis,
mencionaron el papel de Elliot. (Finochieto,
1946).
El manejo del muñón apendicular fue
controvertido por años, mereciendo significativa atención. Fowler describió el método de
invaginación, el cual se volvió enteramente popular en 1895. Dawbarn sugirió el uso de sutura en
bolsa de tabaco sin ligadura del muñón apendicular dentro del ciego, pero el
método fue abandonado en 1926 por los frecuentes reportes de hemorragia
postoperatoria. (Shepherd, 1954).
La utilización de métodos de
“esterilización” del muñón apendicular por agentes químicos o cauterio
fácilmente se volvió popular, los cuales fueron comentados por Nelly en 1905. (Finochieto,
1946).
Los
indices de mortalidad por la apendicitis disminuyeron con la generalizacion del
uso de antibioticos de amplio espectro en los años cuarenta. En 1886, Fitz señaló que la tasa de mortalidad relacionada
con la apendicitis era cuando menos de 67% sin tratamiento quirúrgico. (Fitz,
1886) En la actualidad, la mortalidad por apendicitis aguda publicada es menor de 1%. (Hale , 1997)
Entre los avances mas recientes cabe destacar
los estudios diagnosticos preoperatorios, las tecnicas radiologicas de
intervención para drenar los abscesos periapendiculares establecidos, y el uso de la laparoscopia
para confirmar el diagnostico y descartar otras causas de dolor abdominal.
Actualmente, el amplio uso de
técnicas laparoscópicas por parte de los cirujanos generales ha cambiado el
abordaje quirúrgico de muchas patologías; la apendicectomía es el procedimiento
más común de cirugía general de emergencia (Fitzggibbons, 1999).
En 1977
Dekok realiza extirpación combinada con
laparoscopia y mini laparotomía.
En 1982 el ginecologo Kurt Semm describio por
primera vez la apendicectomia laparoscopica, aunque esta técnica solo ha
alcanzado una aceptacion generalizada durante la pasada decada. (Semm, 1983)
Screiber fue el primero en informar la
extirpación laparoscópica del apéndice en apendicitis aguda. (Cueto, 1998.
De Manzini, 1994). Durante muchos años esta técnica no se expandió,
debido en gran parte a la pobre comunicación existente entre especialistas de
diferente orientación. Esto ocurrió sólo después del auge de la colecistectomía
laparoscópica, en una etapa de comunicaciones extensas y significativas.
En el año 1987, Jörg H Schreiber, quien es el primero
en realizarla en un
paciente ya diagnosticado y reporta una serie de 70 pacientes. Hoy día, esta
técnica es
considerada ''el estándar de oro'' para la apendicectomía.
Más adelante surgió y se desarrolla la Natural
Orifice Translumenal Endoscopic Surgery, conocida por su acrónimo (Notes) que
conjugaba los procederes de tipo endoscópicos menos invasivos si se compara con
la laparoscopía convencional. No es a través de la piel que se consigue acceder
a la cavidad abdominal, sino de orificios naturales como: vulva, vagina,
uretra, boca, estómago, vejiga, colon y recto. Hoy día, el acceso transvaginal
parece el más seguro y factible para su aplicación. El Notes transgástrico se
inició en la Universidad John Hopkins por investigadores donde se destaca
Anthony Kalloo, de inicio lógicamente en animales.
En 2004, se desarrolla la técnica a través de la
pared gástrica.
Ese mismo año y en la India, Rao J, Reddy N y
Banerjee R, realizaron la primera
apendicetomía por acceso transgástrico.
Dos años
después (2006), Palanivelu C y otros,también en la India, fueron los primeros
en hacerla, pero por vía transvaginal según Roesch Dietlen y otros.
Las técnicas Notes y entre ellas la apendicectomía
a través de vagina o trans-Douglas, se intentaron a partir del 2004, según el
reporte de Ram Elazary, Santiago Horgan, Mark A Talamini y otros, todos
cirujanos en Universidades de Jerusalén, Chicago y Nueva
York, respectivamente.
A partir
del 2009, es conocido que la apendicectomía por este proceder se realiza en
todo el orbe; sin embargo, desde sus inicios se difunde sobre todo en India,
Asia y EUA.
Se reconocen tres ventajas en esta cirugía a saber:
a)
no hubo trauma de la pared
abdominal,
b)
más estética y sin dejar cicatriz externa,
c) hay tendencia a olvidar la intervención. Barbaro,
2019.
Se han descrito otros abordajes minimamente
cruentos para la apendicectomia, como la cirugia transvaginal (Palanivelu,
2008) y la laparoscopica por una sola incision (SILS); (Chow, 2009) Apendicectomia transumbilical (2011) sin
embargo, todavia no se han adoptado de forma amplia.
Epidemiologia
La apendicitis
aguda (AA) es la causa más común de abdomen agudo quirúrgico en la actualidad. La apendicitis aguda es la causa más frecuente
de dolor abdominal agudo: representa 47.8% de los ingresos quirúrgicos en los
servicios de urgencias hospitalarias. En Estados Unidos se documentan entre 250.000 y 280.000
casos nuevos al año, con una mortalidad del 0,0002 % y una morbilidad del 3 %
cuando se realiza el diagnóstico y el tratamiento oportuno. (Storm, 2003.
Bobrow, 1996). La probabilidad de presentarla es de 1 en 5 al
nacimiento, 1 en 35 a los 50 años y menor de 1 en 100 a los 70 años. Una de
cada 15 personas presentará un cuadro apendicular agudo en algún momento de su
vida. La
literatura informa el riesgo global de sufrir apendicitis es del 8,6 % para los
hombres y del 6,7 % para las mujeres en todos los grupos de edad. (Addiss,
1990).
Incidencia
por edad
La enfermedad ocurre en todas las etapas pero
es más frecuente en el segundo y tercer decenios de la vida, con una edad pico a los 22 años. (Storm, 2003).
Hay un paralelismo general entre la cantidad de tejido linfoide en el apéndice
y la frecuencia de apendicitis aguda cuyo máximo ocurre a mitad de la
adolescencia. La apendicitis se observa con mayor
frecuencia en sujetos de la segunda a cuarta décadas de la vida, con una edad
promedio de 31.3 años y una edad mediana de 22 años. Luego de los 30 años la incidencia
declina, pero la apendicitis puede ocurrir en individuos de cualquier edad.
El padecimiento es muy raro antes de los tres
años, tal vez debido a la amplitud de la base, lo que dificulta la obstrucción
de la luz apendicular. La incidencia de apendicitis aguda permanece elevada
(51%), con una morbilidad cercana a 25%, tendencia que no ha cambiado en los
últimos 30 años. Los niños menores de 2 años suponen menos del 5% del
total de AA. La incidencia de AA es algo mayor en varones y es más
frecuente en meses cálidos. Se postulan varios factores de riesgo para tener
una AA:
· Genéticos:
el riesgo de AA es mayor si los familiares de primer grado la han tenido. Esto
sobre todo se ve en los niños que la padecen con menos de 6 años
· Infecciosos:
mayor incidencia tras infecciones virales, gastroenteritis, etc.
· Alimentación:
dieta pobre en fibra.
· Después
de un traumatismo abdominal.
A pesar de ser una patología bien conocida y sospechada ante un niño con
dolor abdominal, el diagnóstico en ocasiones continúa siendo difícil, lo que
condiciona errores de diagnóstico (laparotomías en blanco o retrasos en el
diagnóstico) y, por tanto, un aumento de la morbimortalidad.
La apendicitis aguda constituye
una afección quirúrgica pediátrica frecuente, que afecta al 0,3% de los niños
de 0-15 años. (Bargy, 1990). Según la experiencia de los autores, en
el 20,8% de los niños hospitalizados por dolor abdominal se encuentra una
apendicitis. En el niño pequeño, lo más común es que se trate de apendicitis
complicadas. La tasa de apendicitis complicadas, es decir, con un apéndice
perforado asociado a absceso o a peritonitis, es variable según los estudios,
aunque constituye alrededor de una cuarta parte de los casos pediátricos. Esta
tasa era del 19,3% en una serie homogénea de 648 pacientes (Emil, 2003) y del 30% en la serie de lo otros autores. Resulta más elevada cuanto más joven
es el niño. (Hale, 1997. Meier, 2003). Esta frecuencia alta de
apendicitis perforadas y de apendicitis vistas tardíamente en el niño se
debería a la fragilidad de la pared apendicular y a un desarrollo menor del
epiplón mayor. (Snelling, 2004).
Un estudio sueco de 1994 de más de 50.000 de
niños y adultos distinguió, de hecho, dos entidades epidemiológicas (Andersson,
1994):
· Las apendicitis perforadas, secundarias a una obstrucción endoluminal y/o un coprolito, con una
incidencia variable en función del tiempo, del centro estudiado (23 centros),
de la edad del paciente y del «intervencionismo» de los cirujanos (medido por
la exactitud diagnóstica);
· Las apendicitis no perforadas, cuyo número dependía, por el
contrario, de la edad (pico a los 10-14 años), disminuía con el tiempo (más
apendicectomías en el pasado) y estaba en realidad vinculado a la tasa de
exactitud diagnóstica y de apendicetomía sobre apéndice sano.
A pesar de su frecuencia, la
apendicitis no es una enfermedad anodina, con una tasa de morbilidad del 8,5%
en la serie de los autores y de mortalidad inferior al 0,1% en la
literatura (Jones, 2001).
Distribucion
por sexo
Afecta a individuos
independientemente de su sexo, antes y después de la pubertad. La relación de
la apendicitis aguda por sexos es casi 1:1 antes de la pubertad. Entre los adolescentes y los adultos jóvenes.
La relación hombre/mujer es de 2:1 entre los 15 y los 25 años, período tras el
cual la frecuencia en el hombre disminuye gradualmente hasta igualarse con la
de las mujeres. Luego de los 25 años
esta declina en forma gradual hasta ser pareja entre individuos de uno y el
otro sexo hacia los 35 años.
La apendicitis aguda perforada es causante de
5% de los casos de infertilidad tubaria en EUA. La coexistencia con el embarazo
dificulta el diagnóstico de la enfermedad, quizás a causa de cambios de la
posición apendicular y los niveles séricos altos de esteroides, con una
respuesta inflamatoria menor.
Gravedad
Se estima que cada año se
realizan en Estados Unidos unas 250.000 apendicectomías. Las ventajas que la
cirugía mínimamente invasiva tiene en la mayoría de las operaciones abdominales
se han aplicado también a la apendicectomía.
A pesar del uso mayor de la
ecografía, los estudios de tomografía por computadora (CT) y laparoscopia entre
1987 y 1997, la tasa de diagnósticos erróneos de apendicitis es aún constante
(15.3%), al igual que la de la rotura apendicular. El porcentaje de diagnósticos
equívocos de apendicitis es significativamente más alto en mujeres (22.2 contra
9.3%). La tasa de apendicectomías negativas en mujeres en edad de la
reproducción es de 23.2% y la más alta se identifica en mujeres de 40 a 49 años.
La tasa de apendicectomías negativas más elevada comunicada se registra en
mujeres mayores de 80 años de edad. Se acepta que los cirujanos expertos extirpen
apéndices macroscópicamente normales hasta en 15 a 20% de los casos y hasta el
50 % en embarazadas.
En un análisis de 8 732 casos la certeza
diagnóstica preoperatoria en apendicitis aguda no perforada fue de 91.48% y en
apendicitis aguda perforada de 71.55%.Tener una certeza diagnóstica de 100% es
peligroso porque refleja retraso en el diagnóstico y tratamiento. En otro
estudio de 63 707 casos, 84.5% presentó apendicitis aguda (25.8% perforada) y
15.5% no mostró alteración apendicular. La incidencia de pacientes con error
diagnóstico de apendicitis aguda fue más alta (8%) en pacientes mayores de 65
años.
La apendicitis en individuos mayores de 60
años constituye 5 a 10% de todos los casos, lo que incrementa tanto la
morbilidad como la mortalidad. Cuarenta por ciento de los pacientes de esta
edad inicialmente fue visto y tratado como otra enfermedad; 60% de los casos
ocurre entre los meses de septiembre a marzo.
Antes de la aparición de las
técnicas modernas en imágenes diagnósticas, el diagnóstico de la apendicitis
aguda era exclusivamente clínico. El objetivo era disminuir al máximo la tasa
de las apendicitis perforadas. El 20 % de los apéndices cecales resecados, con
un diagnóstico clínico de apendicitis aguda, eran normales; sin embargo, al
tratar de reducir esa cifra de falsos positivos siendo más estrictos con los
criterios de los diagnósticos, aumentaban los casos de perforación.
En resumen, la tasa de falsos
positivos era inversamente proporcional a la tasa de apendicitis perforadas. (Addiss,
1990. Groth, 1999). Después de la introducción de imágenes seccionales
como la tomografía computarizada (TC), resonancia magnética (RM) y la
ultrasonografía (US), como parte de la rutina diagnóstica en esta entidad, las
tasas de apendicectomías negativas disminuyeron de forma significativa a
porcentajes entre el 1,7 y el 3 % sin aumentar los casos de apendicitis
perforadas (Cooperman, 1983. Buchmann, 1984. Chapman, 2005). Los
cuadros de apendicitis perforadas son mas frecuentes en niños y ancianos.
Distribución geográfica
En el mundo, la incidencia de
apendicitis es menor en países en vías de desarrollo, sobre todo en algunas
partes de África y en los grupos de menor nivel socioeconómico. La apendicitis se observa con mayor frecuencia
en América del Norte, Islas Británicas, Australia, Nueva Zelanda y entre los
sudafricanos blancos. Es rara en la mayor parte de Asia, Africa Central y entre
los esquimales. Cuando los habitantes de esas zonas migran hacia el mundo
occidental o adoptan una dieta occidental, la apendicitis se hace más
prevalente, lo que sugiere que la distribución de esta enfermedad está
determinada por el medio ambiente más que genéticamente.
Muchos cirujanos piensan que existe una
tendencia familiar para esta enfermedad, que puede ser explicada por una
malformación hereditaria del órgano. Sin embargo la incidencia de una gran
cantidad de casos en la misma familia puede ser explicada igualmente bien por
la naturaleza frecuente de esta enfermedad.
Recientes datos epidemiológicos
han demostrado una disminución de su incidencia en los países desarrollados y
un aumento en los en desarrollo. (Al-Mmran, 2003). Se ha sugerido
que esta disminución tiene relación con un aumento en el consumo de fibras en
la dieta (Storm, 2003. Pristowsky, 2005.Ishigami, 2004). Es más
común en los individuos de raza blanca.
La franca disminución en el
mundo de apendicectomías por apendicitis aguda en los últimos cuarenta años se
relaciona en forma directa o indirecta con la mejoría de los hábitos
alimentarios, la administración de antibióticos, una mejor nutrición, pero sobre
todo por la mejoría del diagnóstico preoperatorio, pues en muchos de los
apéndices extraídos no se trataba de apendicitis agudas.
Estas cifras deben ser interpretadas con
cuidado. Muchos estudios no hacen diferencias entre todos los casos de
apendicectomía y aquellos en los que el diagnóstico de apendicitis aguda ha
sido confirmado. Otros no confirman el diagnóstico por examen anatomopatológico.
Una declinación de la tasa puede reflejar un cambio en la política quirúrgica o
una mejora de la capacidad diagnóstica del equipo quirúrgico. Deben
considerarse todos estos factores antes de establecer una verdadera declinación
en la incidencia de la apendicitis aguda.
En Mexico
Uno de cada 15-20 mexicanos presentará
apendicitis aguda en algún momento de su vida. La sospecha y diagnóstico de
apendicitis aguda se basa predominantemente en la clínica. La falla en realizar
un diagnóstico temprano eleva la mortalidad y la morbilidad de la enfermedad
así como el riesgo de complicaciones. El diagnóstico retardado incrementa
costos en el servicio de urgencias y hospitalarios. El diagnóstico y
tratamiento temprano de esta patología es imperativo para el cirujano general. El diagnóstico de
apendicitis aguda es generalmente establecido por la historia clínica y la
exploración física (75-90% de exactitud en cirujanos), sin embargo el
diagnóstico es respaldado por estudios paraclínicos de laboratorio e imagen. La
exploración física completa del abdomen debe de incluir tacto rectal y las
mujeres deben ser sometidas a examen pélvico.
El diagnóstico incorrecto o tardío aumenta el riesgo de complicaciones
como infección de herida quirúrgica (8 a 15%), perforación (5-40%), abscesos
(2-6%), sepsis y muerte (0.5-5%) .
Las presentaciones clínicas
difíciles son:
· Niños menores de 3 años de edad
· Adultos mayores de 60 años de edad
· Mujeres en segundo trimestre de embarazo.
En la última revisión de 12 000 casos de
apendicitis aguda realizada en el Servicio de Urgencias del Hospital General de
México, 6 874 casos (57.28%) fueron no perforados y 5 126 (42.72%) perforados.
En México, en el año de 2008, se
atendieron 60,668 casos de apendicitis aguda en todas las instituciones del
sector salud del país, con un total de 225,839 días/ estancia. (Inegi,
2009)
De manera universal el manejo
estándar de la apendicitis aguda es quirúrgico. Algunos autores han abogado por
el manejo médico de la apendicitis aguda no complicada con antibióticoterapia.
Los esquemas más comúnmente utilizados son cefalosporinas de tercera generación
y metronidazol por un total de 10 días. Sin embargo hasta el 15% de los
pacientes presenta recurrencia en un año y hasta 5% como apendicitis
complicada. En la actualidad el manejo conservador deberá reservarse únicamente
a pacientes con alto riesgo operatorio o con múltiples comorbilidades y bajo
estrecha vigilancia. (GPC, 2014)
En el Hospital general de Atizapan
(HGA), Estado de Mexico del Instituto
de salud del estado de Mexico (ISEM) se
realizo una revicion prospectiva de 1 año del 2016 a 2017. Obteniendo los siguientes
resultados De los 182 casos revisados, 110 pacientes
fueron del género masculino y 72 del femenino, con una relación
masculino/femenino de 1.5/1. Con mayor frecuencia de edades entre 10 y 25 años. Hernández-Orduña, 2019
Etiología.
Aunque las causas de la apendicitis aguda son
controversiales: factores genéticos, anatómicos, dietéticos, infecciosos,
parasitarios, inmunológicos, neoplásicos y cuerpos extraños se consideran
desencadenantes, en forma única o multifactorial, y en ellos la obliteración de
la luz apendicular es un aspecto primordial.
El orificio apendicular, redondeado, se encuentra limitado por un
repliegue mucoso, la válvula de Gerlach, de alrededor de 3 a 5 mm de diámetro.
Otro estrechamiento lo constituye la válvula de Manniga, situada en el conducto
apendicular. El apéndice produce aproximadamente 3 ml de mucosidad al día. Dada la
estrechez del orificio apendicular, la obstrucción puede deberse a distintas
causas. Es una enfermedad obstructiva. La oclusión de la luz apendicular es el
factor dominante en su patogenia. Se han descrito varias causas de esta
obstrucción de asa cerrada, tales como:
1.
En primer lugar como factor causal, la hiperplasia de los folículos linfoideos submucosos. La obstrucción de
la luz estaría causada principalmente por una hiperplasia linfoidea en el 60%
al 65% de los casos, especialmente en los
niños y en los adolescentes; esto coincide con el pico máximo de aparición de
la apendicitis aguda. Los folículos linfoideos de la lámina propia
reaccionan a diferentes cuadros infecciosos generales (respiratorios,
sarampión, mononucleosis) o locales (salmonella, shigella: dan una enteritis y
dificultan el diagnóstico). Roux define al apéndice como la amígdala
intestinal, capaz de reacción ante cualquier cuadro inflamatorio.
Esta
causa de obstrucción luminal, que es más común en la primera y segunda
infancia, reactiva a una infección respiratoria puede desencadenar aumento de
presión y la consiguiente inflamación del órgano.
Figura 2. En el gráfico vemos un corte transversal de un apéndice, visto al microscopio óptico donde se objetiva una marcada reducción de la luz y una dilatación importante de los folículos linfoideos de la lámina propia de la mucosa apendicular.
2.
Los fecalitos como causa de la obstrucción se han descrito en el 35% al
40%. La presencia de un fecalito asintomático tal
vez sea razón suficiente para sospechar que en algún momento se desarrollará la
apendicitis aguda. No es infrecuente que el paciente presente síntomas
recurrentes en el cuadrante inferior derecho que remiten en forma espontánea,
lo cual puede ser ejemplo de un fecalito que sale del apéndice en forma
espontánea.
Se encuentran fecalitos en 40% de las
apendicitis agudas simples, en casi 65%
de las gangrenadas sin rotura y en un 90% de estas últimas con rotura. El
Fecalito es la causa más común en adultos: su
aparición se ve favorecida por el estreñimiento y la mayor consistencia de las
heces; se impacta coprolito o fibra vegetal no digerida, sobre la que sedimenta
moco y obstruye la luz.
Figura 3. En ésta toma fotográfica endoscópica de ciego vemos la concreción de fibras vegetales, materia fecal y moco obturando el pliegue mucoso de Gerlach, (válvula apendicular). Fecalito extraido de la valvula en etapa postquirúrgica. Foto del autor.
Normalmente se encuentra materia fecal tanto
en el apéndice normal como en el inflamado, que debe ser diferenciada del
verdadero fecalito, que es ovoide, de aproximadamente 1 a 2 cm de longitud, con
color fecal. Contrariamente a las heces normales, el verdadero fecalito muestra
una laminación bien ordenada en el corte. La gran mayoría de ellos son
radioopacos y, en el 10% de los casos de apendicitis aguda contienen suficiente
calcio como para ser detectados en una placa simple de abdomen. En un estudio de
240 casos de apendicitis aguda en los cuales se radiografió la muestra de
apéndice, se detectaron fecalitos en el 33% de los casos. Cuando había un
fecalito, el 77% de las muestras eran gangrenosas, en comparación con el 42% en
los que no había evidencias de éste. (Maingot, 2007
3. Luego siguen en frecuencia los cuerpos extraños (semillas de frutas, legumbres y restos alimentarios no digeridos), los cuales representan el 4% de los casos,
4.
Parásitos como áscaris, oxiuros, Entamoeba histolytica, Enterobius vermicularis,
Ascaris lumbricoides, etc.,
hasta en el 0.1% de los casos.
Figura 4 . Vemos una endoscopía con un hallazgo de áscaris en luz cecal y un ovillo de parásitos.
5. Solidificación del bario en
estudios radiológicos y Apendicitis
por bario retenido: En
algunos pacientes, la realización de exámenes radiológicos baritados tiene como
consecuencia la persistencia de bario retenido en el fondo apendicular. La
mayoría de estos pacientes permanecerán asintomáticos, pero en otros casos se
producirá la instauración de un cuadro clínico sugestivo de apendicitis aguda.
Figura 5 . Radiografía simple de abdomen que muestra la presencia de bario retenido en la fosa ilíaca derecha, 3 semanas después de un tránsito esofagogastroduodenal, en un paciente con clínica sugestiva de apendicitis aguda.
6.
Tumores apendiculares. Aparte de estas
situaciones, una apendicitis puede ser el modo de revelación (infrecuente) de
un tumor; en este caso, se trata de una forma complicada. tumores apendiculares (carcinoide), tumores de ciego que en su
crecimiento afectan la base apendicular.
La presencia del carcinoide es de 0.05%, la de
mucocele de 0.02%, que es la dilatación de la luz apendicular por la presencia
de secreción mucinosa. En el cistoadenocarcinoma del ovario con metástasis
microscópicas a distancia, hasta en 31% de los casos puede afectar el apéndice
y su extirpación sirve para estadificar el tumor (-1%)
Figura 6. Neoplasia de ciego: endoscopía baja, donde el
fibroscopio viene descendiendo por el colon ascendente y vemos el ciego desde
arriba. Entre las horas 1 y 7 vemos aumento del espesor de la pared, coloración
rojiza y máculas blanquecinas, lo que corresponde al tumor cecal. Bien hacia el
fondo, en forma triangular la válvula de Bahuin (1) y hacia la derecha el
orificio apendicular con el pliegue de Gerlach. (2)
7. Enfermedad De Crohn. En pacientes con HIV/SIDA se puede
presentar apendicitis secundaria a una infección abdominal por CMV
(citomegalovirus) (Un 30% de las apendicitis en HIV son por CMV)
8. Otros mecanismos
vasculares y torsión del apéndice, siendo su causa principal las
adherencias. La apendicitis aguda reactiva se
presenta como consecuencia de procesos inflamatorios de órganos
intraabdominales como útero y anexos, íleon terminal, vesícula biliar,
estómago, páncreas, entre otros.
9. Se ha invocado el trauma
cerrado del abdomen como antecedente en la apendicitis aguda. Para
aceptar esta causa, será necesario que exista pérdida de la integridad de la
mucosa apendicular y daño vascular y que el cuadro peritoneal de la apendicitis
aguda se produzca poco después de la contusión. Como principio solo se aceptará
lo que produzca una inflamación aguda del apéndice, la existencia de
obstrucción luminal del apéndice e infección.
10. Quizá
la causa más rara de apendicitis obstructiva sea la estrangulación
del apéndice dentro de un saco hemiario. Thomas y col. publicaron siete
de estos casos. La hernia involucrada más a menudo es la femoral derecha,
seguida por la inguinal derecha. Sin embargo, también se han comunicado casos
de un apéndice agudamente inflamado dentro de una hernia inguinal izquierda,
una hernia umbilical, una eventración y una hernia obturatriz. Por supuesto el
diagnóstico habitual es de hernia estrangulada y virtualmente nunca se ha
realizado el diagnóstico correcto antes de la operación.
11. Ulceraciones superficiales de la mucosa. Las bacterias, virus y
parásitos pueblan e infectan la mucosa del órgano. Esta se ulcera de forma
superficial y se produce infestación bacteriana subsecuente en un inicio desde
la flora normal. En 75 % de los casos, hay ulceraciones superficiales de la
mucosa que es mucho
más frecuente que la dilatación de la luz apendicular y los fecalitos y que
aparece temprano en AA. Un reporte citado, halla expresión antigénica bien
precoz en 64 % de los enfermoscon AA contra citomegalovirus humano y que no se
observa en aquellos con el apéndice cecal sano. Barbaro, 2019
12. La higiene En
1980, Barker CJ y otros, hicieron énfasis en el rol de la infección como causa
de la AA y encontraron dos líneas de evidencias: una
basada en la teoría de la higiene y la otrabasada en el desarrollo social,
industrial y económico de la población. Estos aspectos tienden a disminuir la
infección gastrointestinal en niños y que conlleva a disminuir la inmunidad de
esta población a los microorganismos en jóvenes y adultos jóvenes, por tanto, hay
una tendencia a disminuir la aparición de AA, pero si apareciera una infección,
esta predispone, dada la poca defensa del organismo a que aparezca la AA, la
cual tiene tendencia a aumentar. Así, “El rol de la infección en AA no es una
historia concluida”. Barbaro, 2019
13. Hipótesis de las fibras dietéticas Actualmente, el aporte de alimentos ricos en fibra
dietética va en descenso. Esto hace que el contenido intestinal en estas
personas sea más firme y sólido, con incremento de fecalitos y aceleración del
tránsito intestinal; por lo tanto, aumentan los casos de AA y sus complicaciones.
Los datos epidemiológicos sugieren
fuertemente que la forma complicada de apendicitis (perforada, gangrenada) no
es la evolución de la forma no complicada (catarral, flemonosa), sino que se
trata de dos formas de apendicitis aguda de distinta fisiopatología. Un
epidemiólogo estadounidense ha demostrado que la incidencia de las formas no
complicadas (el 70% de las apendicitis agudas) presenta una variación
estacional y ha tendido a disminuir en los últimos 30 años, acercándose a la de
los divertículos sigmoideos no complicados (Livingston, 2007. Hay, 1992).
En cambio, la incidencia de las formas complicadas (el 30% de las apendicitis
agudas) se mantiene estable desde hace 30 años y es similar a la de las
diverticulitis sigmoideas complicadas.
Fisiopatología
La inflamación del apéndice se origina por
una obstrucción luminal y pasa por una serie de estadios evolutivos
anatomopatológicos secuenciales, es por esto que decimos que existen cuatro
tipos de apendicitis, en base al tiempo de evolución del cuadro.
Es probable que la secuencia de fenómenos consecutivos a la oclusión de la luz sea la siguiente: un bloqueo proximal produce obstrucción de asa cerrada y la secreción normal constante de la mucosa apendicular causa distensión con rapidez.
Apendicitis
congestiva o catarral
Una vez
instalada la obstrucción (capacidad normal de luz apendicular 0.1 ml) se
produce acumulación de moco en la luz apendicular con lo que aumenta la presión
intraluminal dando como resultado distención y estimulo de fibras aferentes que
se traduce clínicamente como dolor visceral difuso, vago, sordo, periumbilical
o en epigastrio que se acompaña generalmente por anorexia, náuseas
y, a veces, vómitos.
Continua
aumentando la distención por: Secreción aumentada y multiplicación de bacterias lo que nos
lleva a una Obstrucción de flujo linfático por aumento de la presión (60 cm de
H2O con 0.5 ml) y por la falta de elasticidad de la serosa. Dicho aumento de la
presión compromete el retorno venoso con lo que se produce acumulación
bacteriana y se ve una reacción de los folículos linfoideos que producen un
exudado plasmo leucocitario que va infiltrando las capas superficiales del
apéndice.
El peristaltismo también se estimula por el
aumento súbito de la distensión, de manera que es posible que al inicio de la
evolución de la apendicitis se superpongan algunos cólicos en el dolor
abdominal.
Figura 7 apendicitis aguda en etapa 1 o catarral, Macroscópicamente vemos un apéndice con edema, engrosado y con congestión de la serosa con vasos ingurgitados. Imagen del autor.
Esquema 1 de proceso fisiopatológico en la etapa 1. Nota del autor.
Apendicitis flemonosa o supurativa
Ante el cuadro inflamatorio, la mucosa
apendicular continúa secretando moco, con lo que aumenta aún más la presión
intraluminal. Aparecen pequeñas ulceraciones en la mucosa la que es invadida
por enterobacterias con lo que transforman el exudado en mucopurulento.
Conjuntamente vemos un importante infiltrado de polimorfonucleares de todas las
capas del órgano hasta la serosa. Las bacterias atraviesan la pared del órgano y
surge la apendicitis aguda supurada.
Al disminuir la peristalsis intestinal,
aumenta el número de bacterias y, por falta de recubrimiento de sales biliares
e inmunoglobulina A, las bacterias se adhieren a la pared intestinal; con la
disminución de su circulación se produce hipotrofia de las vellosidades
intestinales, con relajación de la unión celular del epitelio intestinal,
aumento de radicales superoxidantes, disminución de macrófagos y libertad
bacteriana que estimula la traslocación. La Serosa inflamada irrita el peritoneo parietal
dando como resultado clínico Dolor somático dado por fibras aferentes
viscerales y provoca la clásica
migración del dolor a la fosa ilíaca derecha aproximadamente a las 6-36
horas.
Figura 8. Apendicitis aguda en
etapa 2 Macroscópicamente vemos la serosa intensamente congestiva,
edematosa, de coloración rojiza y con exudado fibrinopurulento en su
superficie. Imagen del autor.
Esquema 2 de proceso
fisiopatológico en la etapa 2 de apendicitis aguda. Nota del autor.
Apendicitis gangrenosa o necrótica
Al
aumentar la presión intraluminal se compromete el riego arterial, con la anoxia
tisular y mayor virulencia y proliferación bacteriana, en especial de anaerobios. Conforme la proliferación bacteriana continúa
se absorben toxinas y se observan fiebre, taquicardia y leucocitosis; conforme
la distensión progresa y excede la presión arteriolar, al principio se forman
infartos en el borde antimesentérico (apendicitis gangrenada o necrótica) ya
que es una arteria terminal; éstos son los primeros sitios susceptibles de
perforación. Si ésta ocurre, puede sellarse con el epiplón o intestino
adyacente, el proceso infeccioso se aísla y se forma un absceso. Cuando esta
barrera falla se produce una peritonitis generalizada y en algunas ocasiones
lisis total del apéndice. La evolución natural de este cuadro lleva a sepsis
abdominal con morbimortalidad alta. En esta etapa se producen pequeños infartos
que permiten el escape de bacterias y la contaminación de la cavidad
peritoneal.
Imagen 9 de apéndice en etapa 3. Macroscópicamente el
apéndice presenta áreas
de color púrpura,
verde gris o
rojo oscuro, con microperforaciones, aumenta el líquido
peritoneal, que puede ser tenuamente purulento con un olor fecaloideo. Imagen del autor.
Apendicitis perforada
La etapa final de la progresión de la
apendicitis aguda es la perforación a través de un infarto gangrenoso y el
derrame de pus acumulado. Ahora se está en presencia de apendicitis perforada,
y la morbilidad y la mortalidad aumentan. A medida
que la distensión progresiva supera los límites de la presión arteriolar, sufre
más el área con mayor deficiencia de riego —se presentan infartos elipsoidales
en el borde antimesentérico—. Igual que la distensión, la invasión bacteriana
compromete el riego y los infartos progresan, ocurre perforación, por lo
general a través de una de las áreas de infarto en el borde antimesentérico.
Por lo regular, la perforación tiene lugar justo después del punto de
obstrucción, no tanto en la punta por el efecto del diámetro sobre la tensión
intraluminal. El apéndice puede romperse en cualquier sitio, pero lo más
frecuente es que el lugar de la perforación se encuentre a lo largo del borde
antimesentérico en el tercio medio y en la punta por la debilidad muscular.
Ahora bien la disminución de
perístalsis, aumento en el Número de bacterias y disminución de Ig A; más la
Adherencia bacteriana, Relajación de unión celular, aumento de Radicales
superóxidos, disminución de macrófagos y aumento en la Migración bacteriana nos
da como resultado Infartos, gangrena, Micro perforación, Translocación, Absceso
apendicular y Perforación ( borde antimesentérico o vértice)
Imagen 10 que muestra apéndice perforado en borde
antimesenterico del tercio medio. Imagen del autor.
Después de la perforación puede formarse un
absceso localizado en la fosa ilíaca derecha o en la pelvis con formación de un Flemón (masa de intestinos aglomerados
inflamados y epiplón) y/o Absceso en Hueco pélvico derecho, subhepático o
interesa, o puede sobrevenir una peritonitis difusa. El exudado fibrinoso inicial produce la adherencia de epiplón y de las
asas delgadas adyacentes, a manera de mecanismo de defensa que intentará
bloquear el proceso para impedir una peritonitis generalizada. Esto se denomina
plastrón apendicular. Cuando la perforación se lleva a cabo dentro de un
plastrón y el proceso inflamatorio e infeccioso dentro del plastrón digiere el
apéndice y producen pus, hablamos de lo que se denomina absceso
apendicular.
Depende
de muchos factores que la peritonitis permanezca localizada o se generalice,
entre ellos la edad del paciente, la virulencia de la bacteria invasora, la
velocidad con la que ha progresado el cuadro inflamatorio dentro del apéndice y
la posición del órgano asi como la respuesta del peritoneo.
Esta secuencia no es
inevitable; al parecer algunos episodios de apendicitis aguda remiten de manera
espontánea. Muchos enfermos en quienes se encuentra apendicitis aguda en una
operación proporcionan un antecedente de ataques previos similares pero menos
intensos de dolor en el cuadrante inferior derecho. El examen anatomopatológico
del apéndice extirpado de estos enfermos suele mostrar engrosamiento y
cicatrización que sugiere inflamación aguda antigua cicatrizada. La posible
obstrucción de la luz, cuando se debe a hipertrofia linfoide o un fecalito
blando, puede aliviarse de manera espontánea y permitir que remitan la
inflamación apendicular y los síntomas concurrentes.
Con base en esa secuencia de
estadios evolutivos, el apéndice con signos de inflamación leve se conoce como catarral o mucosa; flegmonosa; purulenta, pasando luego a gangrenosa perforándose, puede evolucionar a
un absceso apendicular o a un plastrón apendicular, o una etapa más grave: la
peritonitis aguda difusa.
Las apendicitis agudas no
complicadas pueden ser catarrales (infiltración de leucocitos
polimorfonucleares y ulceraciones de la mucosa del apéndice, lesiones
indispensables para el diagnóstico positivo de apendicitis aguda) o flemonosas
(infiltración edematosa de toda la pared). Las apendicitis agudas complicadas
son de dos tipos: gangrenosas o
perforadas. Es muy probable que la perforación sea la consecuencia de una
gangrena localizada de la pared del apéndice.
Anatomía patológica.
Las
apendicitis agudas no complicadas pueden ser catarrales (infiltración de
leucocitos polimorfonucleares y ulceraciones de la mucosa del apéndice,
lesiones indispensables para el diagnóstico positivo de apendicitis aguda) o
flemonosas (infiltración edematosa de toda la pared).
Las
apendicitis agudas complicadas son de dos tipos: gangrenosas o perforadas. Es
muy probable que la perforación sea la consecuencia de una gangrena localizada
de la pared del apéndice. El estercolito es un factor predictivo de perforación
apendicular, por lo que se cree que causa una necrosis de la pared del apéndice
y no una «obstrucción» como se sostenía.
Los datos
de la exploración física rara vez permiten prever la forma complicada o no
complicada de una apendicitis (mientras no se produzca la peritonitis
generalizada). Es la clásica disociación anatomoclínica que ha impulsado a
tantos clínicos y cirujanos a indicar la cirugía antes de exponerse a pasar por
alto una forma complicada. Por último, la realización sistemática del
estudio anatomopatológico permitiría diagnosticar un tumor.
Al principio el apéndice puede tener aspecto
normal externamente o mostrar solo una hiperemia; sin embargo, cuando el
apéndice se habré a lo largo, se ve que la mucosa esta engrosada, edematosa y
enrojecida.
En el proceso evolutivo de la apendicitis
aguda se distinguen cuatro estadios:
Apendicitis catarral o mucosa. El proceso afecta sólo la mucosa y la
submucosa (edema e hiperemia de la mucosa e infiltrado de células inflamatorias
de la submucosa). El aspecto macroscópico desde el exterior es normal. Al principio, el apéndice puede tener aspecto
normal externamente o mostrar sólo una hiperemia. Sin embargo, cuando el
apéndice se abre a lo largo, se ve que la mucosa está engrosada, edematosa y
enrojecida; más tarde aparece salpicado de infartos hemorrágicos marrón oscuro,
placas de gangrena verde grisácea o pequeñas úlceras. Por último, todo el
apéndice se vuelve tumefacto y turgente y la serosa se hace rugosa, pierde su
brillo saludable y se cubre de un exudado fibrinoso. La causa probable de este
cuadro es la invasión bacteriana del tejido linfoide dentro de la pared
apendicular. Es probable que algunos casos sean manifestaciones locales de una
enteritis generalizada. Debido a que la luz del apéndice no se encuentra
obstruida, estos casos raramente progresan hacia la gangrena. En muchos pacientes,
el ataque inflamatorio agudo se resuelve espontáneamente. En otros, sin
embargo, el edema del tejido linfoide de la pared del apéndice puede producir
la obstrucción de la luz y el cuadro puede progresar a una apendicitis
obstructiva con gangrena. Aun cuando el proceso inflamatorio agudo ceda, es
probable que el apéndice no recupere nunca su estado original; la formación de
adherencias y el acodamiento del apéndice pueden dar origen a un episodio final
de apendicitis aguda obstructiva. Un episodio de apendicitis gangrenosa puede
estar precedido por varios ataques leves que se resuelven espontáneamente
Imagen 11 del autor En la mucosa se aprecian erosiones y ulceraciones. En la submucosa y en la muscular hay un intenso infiltrado inflamatorio. Este infiltrado confiere al apéndice un color rojo oscuro. En la serosa se aprecia un exudado de fibrina que produce adherencias del apéndice a órganos vecinos, sobre todo al epiplón.
Apendicitis purulenta. La luz apendicular se
encuentra ocupada por material purulento. En la pared aparecen microabscesos.
El apéndice está dilatado, rígido, con exudado purulento periapendicular que se
origina por el pasaje transmural de gérmenes o por la perforación de microabscesos.
Apendicitis gangrenosa. La isquemia de la pared condiciona zonas de gangrena y necrosis. Estas
zonas acaban por desprenderse, produciéndose perforaciones de la pared
apendicular y contaminación de la cavidad abdominal.
Apéndice - Corte histológico
Las
células mucosas presentan a la microscopía electrónica bordes en cepillo con
gránulos argentafines secretores de serotonina. Después de la mucosa vemos una
lámina propia totalmente infiltrada por
linfocitos aislados y formando los característicos folículos linfoideos que
forman un anillo completo, importantísimo en la histopatogenia de la
apendicitis.
La submucosa, muscular y serosa no difieren del recto.
Imagen 12 Microscópicamente con
infiltrado de PMN característico de cuadro agudo en la apendicitis
aguda. .
Microbiologia
La flora del apendice normal es muy parecida a
la del colon, con una gran variedad de bacterias aerobias facultativas y
anaerobias. La apendicitis aguda no se asocia con ningún agente invasor
específico, bacteriano, viral o protozoo. Las bacterias que se encuentran en el
órgano inflamado son las mismas que se observan en la flora intestinal normal,
lo que sugiere una invasión secundaria del tejido lesionado a partir de la luz
intestinal. Es bien conocido el caracter
polibacteriano de la apendicitis perforada.
Un estudio detallado de las poblaciones
bacterianas de 50 apéndices inflamados produjo cultivos positivos aerobios y
anaerobios en todos los casos. Se encontraron con mayor frecuencia bacterias
anaerobias que aerobias. Entre las cepas
anaerobias predominó Bacteroides fragilis. Los siguientes en frecuencia
fueron los cocos gram positivos anaerobios, y se obtuvieron cultivos de Clostridium
perfringens en nueve pacientes. Escherichia coli fue la bacteria
aerobia más frecuente, otros bacilos aerobios gramnegativos, Klebsiella,
Proteus y Pseudomonas. Se encontraron enterococos (Streptococcus
faecalis y S. faecium) en 15 pacientes y otros estreptococos (S. minor,
S. milleri y S. salivarius) en 21 pacientes. (Samperio,) En
un paciente con síndrome de inmunodefíciencia adquirida se observó apendicitis
relacionada con citomegalovirus.
|
Tabla 1 Microorganismos
comunes en apendicitis aguda |
|
|
Aerobios y
facultativos |
Anaerobios |
|
Bacilos gram
negativos: Pseudomona aeruginosa Klebsiella |
Bacilos gram negativos: Bacteroides fragilis Especies de bacteroides Especies de fusobacterium |
|
Cocos grampositivos: Streptococcus
anginosus Especies de
streptococcus Especies de
enterococcus |
Cocos grampositivos: Especies de
peptoestretococcus. Bacilos grampositivos: Especies de
clostridium. |
|
Tabla 2 bacterias que suelen aislarse en las
apendicitis perforadas. |
|
|
Tipo de bacteria pacientes |
(%) |
|
Anaerobias Bacteroides fragilis Bacteroides thetaiotaomicron Bilophila wadsworthia Peptostreptococcus
|
80 61 55 46 |
|
Aerobias Escherichia
coli Streptococcus
viridans Estreptococos del grupo D
Pseudomonas
aeruginosa |
77 43 27 18 |
En muchos casos de adenitis mesentérica no se
identifica una causa infecciosa, pero es posible que exista. En general, la
enfermedad se descubre cuando se lleva a cabo la cirugía porque se sospechaba
apendicitis. Los ganglios linfáticos mesentéricos de la fosa ilíaca derecha se
encuentran dilatados, el intestino adyacente sólo está levemente inflamado y el
apéndice parece normal. No obstante, debe realizarse una apendicectomía para
evitar la necesidad de distinguir en el futuro un ataque recurrente de la
apendicitis verdadera.
Se cree que Yersinia enterocolitica y Yersinia
pseudotuberculosis tienen un papel etiológico en algunos casos de
apendicitis aguda.Sin embargo, estas especies de Yersinia suelen causar
ileotiflitis o adenitis mesentérica, que parecen apendicitis aguda con fiebre,
leucocitosis y dolor agudo en el cuadrante inferior derecho Campylobacter y
Salmonella no tifoidea también pueden causar ileotiflitis y adenitis
mesentérica. Es más frecuente que la tuberculosis apendicular o ileocecal, la
actinomicosis y la histoplasmosis causen enfermedad subaguda o recurrente antes
que apendicitis aguda clásica. Entre las causas virales de adenitis mesentérica
y, raramente, apendicitis, se encuentran el sarampión, el virus de
Epstein-Barr, los citomegalovirus y los adenovirus
En los pacientes con
apendicitis aguda sin perforar, los cultivos del liquido peritoneal son
negativos a menudo y tienen una utilidad limitada. En los pacientes con
apendicitis perforada, los cultivos del liquido peritoneal suelen ser positivos
y revelan la presencia de bacterias colicas con una sensibilidad predecible.
Dado que no es frecuente que los resultados de estas pruebas alteren la
eleccion o la duracion de la antibioterapia, algunos autores han cuestionado la
practica tradicional de obtener cultivos.
Es dudoso el
uso sistemático de cultivos intraperitoneales en sujetos con apendicitis
perforada o no perforada. Como se comentó, se conoce la flora y por tanto están
indicados antibióticos de amplio espectro. Para el momento en que se dispone de
los resultados del cultivo, muchas veces el enfermo ya se recuperó de la
afección. Además, varían en grado considerable el número de microorganismos
cultivados y la capacidad de un laboratorio específico para cultivar
microorganismos anaerobios. Los cultivos peritoneales deben reservarse para
aquellos individuos con inmunodepresión, como resultado de la enfermedad o por
medicamentos, y personas que desarrollan un absceso después de tratar la
apendicitis. La profilaxis antibiótica es eficaz para evitar la infección posoperatoria
de la herida y la formación de abscesos intraabdominales. La protección con
antibióticos se limita a 24 a 48 h en casos de apendicitis no perforada. En una
apendicitis perforada se recomiendan siete a 10 días. Por lo regular se
administran antibióticos intravenosos hasta que se normaliza la cuenta de
glóbulos blancos y el paciente no tiene fiebre durante 24 h.
Clasificación
De manera
tradicional, la clasificación de la apendicitis aguda se ha dado en cuatro fases
de acuerdo con los hallazgos transoperatorios anatomopatológicos macroscópicos;
sin embargo, estos no definen claramente la gravedad de la contaminación de la
cavidad peritoneal, ni su repercusión sistémica en el paciente.
Clasificar, es decir, ordenar o disponer por clases,
es la operación lógica que facilita la exposición del pensamiento en cualquier
actividad y, por tanto, permite orientar la toma de decisiones. La
clasificación actual de la apendicitis aguda en no perforada y perforada parece
más una descripción de los hallazgos que una clasificación, la cual no nos
orienta en la toma de decisiones, ya que no es lo mismo una apendicitis fase 4
sellada que una fase 4 con material purulento libre en toda la cavidad o material
fecaloide, e incluso con lesión a órganos vecinos; entonces ¿por qué
clasificarlos y manejarlos de la misma manera? Complicaciones posteriores al
manejo inicial conllevan la necesidad de estudios imagenológicos,
procedimientos invasivos, mayor tiempo de manejo antibiótico y prolongación de
la estancia hospitalaria con reportes de hasta un 58% en la tasa de
complicaciones, cuando la presentación inicial del cuadro es con apendicitis
perforada.
Debido a la importancia de esta patología por su
alta frecuencia, es necesario identificar si la clasificación de la apendicitis
aguda refleja su gravedad, guiándonos a realizar de manera adecuada la
intervención quirúrgica y si esta conducta quirúrgica en cada caso repercute en
las complicaciones, las reintervenciones y en la estancia hospitalaria.
El paradigma de una apendicitis aguda complicada
debe cambiar, no es sólo el apéndice, ya que tenemos dos entidades: el apéndice
y una cavidad peritoneal con peritonitis secundaria con las consecuencias que
implica, tanto locales como sistémicas, las cuales se deben manejar en forma
adecuada, sin propiciar ni esperar la peritonitis terciaria o el abdomen
hostil, lo que nos puede llevar a choque séptico y muerte.
Clasificaciones de apendicitis aguda
A lo largo de los años, la clasificación de la
apendicitis aguda ha sido tema de debate. La más utilizada de forma tradicional
por los cirujanos se basa en la observación macroscópica de los hallazgos
quirúrgicos y se divide en cuatro estadios: fase 1 eritematosa o catarral,
fase 2 supurativa o flegmonosa, fase 3 necrosada y fase 4 perforada. Sin
embargo, como es evidente, no define claramente la gravedad de la patología ni
su repercusión en la cavidad peritoneal o sistémica. Además, esta
clasificación no tiene un sustento bibliográfico, por lo que algunos autores
utilizan otras: apendicitis aguda complicada o no complicada, apendicitis aguda
perforada o no perforada. Lo cual demuestra que no existe un consenso unificado
para su clasificación. Por lo que se han utilizado otras clasificaciones: la
clínico-etiológica (no obstructiva perforada o no perforada, obstructiva
perforada o no perforada, y por obstrucción vascular); evolutiva (sin
perforación o con perforación, agregando peritonitis local o difusa); y
topográfica de acuerdo con las variantes anatómicas de la punta apendicular.
Maingot en el 2008 claramente define la extensión de
la enfermedad, sobre todo en casos complicados, dando puerta al manejo para
cada fase (1. apendicitis aguda no perforada y 2. Perforada; a) con absceso
local y b) peritonitis generalizada); sin embargo, tampoco es lo mismo
apendicitis aguda con fecalitos libres o sin ellos, con materia fecal libre o
sin ella y en cuántos cuadrantes se encuentra o si está generalizada, además el
estado de tejidos adyacentes puede ser íleo o ciego si se encuentra necrosado
o con perforaciones amplias y más importante el estado sistémico del paciente.
En el 2003, el Dr. Gilberto Guzmán clasificó la
apendicitis de acuerdo con los hallazgos quirúrgicos de la siguiente manera
muy parecida a la de Maingot: grado 0 sin apendicitis; Ia apéndice edematoso e
ingurgitado; Ib apéndice abscedado o flegmonoso; Ic apéndice necrosado sin
perforación; II apéndice perforado con absceso localizado; y III apendicitis
complicada con peritonitis generalizada. Esta clasificación es una adaptación
de la de Maingot y, al igual que él, se enfoca sólo en el apéndice sin enfatizar
tejidos adyacentes y el manejo en cada caso.
Recientemente la clasificación propuesta por la
Asociación Mexicana de Cirugía General (I. Apendicitis aguda 1. No perforada:
a) edematosa, hiperémica, b) abscedada, flegmonosa, c) necrótica. 2. Perforada: a) abscedada
con peritonitis localizada, b) peritonitis generalizada. 3. Apendicitis aguda
reactiva. II. Apendicitis crónica) sí define extensión de la contaminación de
la cavidad; sin embargo, no de los tejidos periapendiculares o estado sistémico
del paciente. Tampoco nos guía en la toma de decisión del manejo quirúrgico y
postquirúrgico.
En el 2012, Gomes propone una clasificación de
acuerdo con los hallazgos laparoscópicos en: grado 0 apéndice de aspecto
normal; grado 1 hiperemia y edema; grado 2 exudado fibrinoso; grado 3A necrosis
segmental; grado 3B necrosis de base; grado 4A absceso; grado 4B peritonitis
regional; y grado 5 peritonitis difusa.9 El objetivo de este nuevo sistema fue
proporcionar una clasificación estandarizada para permitir una estratificación
del paciente más uniforme para la investigación de la apendicitis y ayudar a
determinar el manejo óptimo según el grado.
El mismo autor en 2015 da una nueva propuesta de un
nuevo sistema de clasificación de apendicitis aguda basado en hallazgos
clínicos, de imagen y laparoscópicos, clasificándola en: 1) apendicitis aguda
no complicada, subdividida en grado 0 apéndice de aspecto normal
(endoapendicitis/periapendicitis); grado 1 apéndice inflamado (hiperemia,
edema de fibrina sin o poco líquido pericólico). 2) apendicitis aguda
complicada subdividida en grado 2 necrosis, A - necrosis segmental, (sin o poco
líquido pericólico), B - necrosis base, (sin o poco líquido pericólico). Grado
3 - tumor inflamatorio. A - Un Flemón. B - Absceso menos de 5 cm sin aire libre
peritoneal. C - Absceso superior a 5 cm sin aire libre peritoneal, y grado 4 -
perforado - peritonitis difusa con o sin aire libre peritoneal. Esta clasificación
nace por la observación del autor, es necesario un nuevo sistema de
clasificación integral para la apendicitis aguda, debido a que las opciones de
tratamiento para los casos complicados de apendicitis aguda incluyen
modalidades no operativas.
El porcentaje de complicaciones aumenta de acuerdo
con el tipo de apendicitis aguda y su grado de evolución. Las más frecuentes
son las complicaciones infecciosas, abscesos de pared y abscesos
intraperitoneales, pero pueden observarse también peritonitis terciarias y
abdomen hostil, lo que nos puede llevar a sepsis abdominal y choque séptico.
Lo importante de una clasificación es dar pauta al
manejo quirúrgico, homogeneizar el tratamiento, predecir complicaciones de
acuerdo con los hallazgos quirúrgicos y facilitar el proceso de sanación en la
evolución del paciente, así como el proceso de enseñanza aprendizaje de los
residentes de cirugía. De esta manera se puede decidir el manejo disminuyendo
la prolongada estancia intrahospitalaria innecesaria.
Debemos tomar en cuenta que clasificar es disponer
un conjunto de datos por clases o categorías en función de un criterio. Agrupar
elementos siguiendo algún criterio, entonces, clasificar es la operación lógica
que facilita la exposición del pensamiento en cualquier actividad y, por tanto,
permite orientar la toma de decisiones. Para tratar de comprender en la
apendicitis aguda el sistema de clasificación de lesiones ideal, debería estar
diseñado para cumplir las siguientes condiciones:
1.
Que
proporcione una descripción exacta del estado de la lesión del apéndice cecal,
tejidos circunvecinos y el grado de contaminación de la cavidad peritoneal.
2.
Que
determine el tratamiento quirúrgico más adecuado según el grado de la lesión.
3.
Debe ser
útil en el cálculo del pronóstico ante una posible complicación.
4.
Que se
ajuste a las recomendaciones del manejo quirúrgico de la apendicitis aguda
complicada.
5.
Que
establezca normas para la prevención de infección del sitio quirúrgico,
peritonitis terciaria o abdomen hostil.
Es por todo ello que se sugiere la siguiente
clasificación de apendicitis aguda, correlacionándola con el manejo
quirúrgico. Los hallazgos son determinados por el cirujano durante el
intraoperatorio y serán descritos según la clasificación utilizada.
|
Tabla 8: Clasificación integral de la gravedad y manejo sugerido
de apendicitis aguda. Hernandez-Orduña, 2020 |
||||
|
Estadio 1 |
Estadio 2 |
Estadio 3 |
Estadio 4 |
Estadio 5 |
|
• Apendicitis aguda sin perforación a. Eritematosa, edematosa b. Abscedada c. Necrosada |
•
Apendicitis aguda perforada con absceso localizado |
•
Apendicitis aguda perforada con peritonitis generalizada purulenta |
•
Apendicitis aguda perforada con peritonitis generalizada purulenta +
fecalitos libres |
•
Apendicitis aguda perforada con peritonitis generalizada y necrosis ileal o
cecal |
|
Manejo sugerido |
Manejo sugerido |
Manejo sugerido |
Manejo sugerido |
Manejo sugerido |
|
• Apendicectomía y secado |
•
Apendicectomía, secado y drenaje |
•
Apendicectomía, lavado de cavidad (sin drenaje) |
•
Apendicectomía + lavado exhaustivo y nueva laparatomía sistemática en 48
horas conforme a los criterios de intervención |
•
Apendicectomía + hemicolectomía derecha con/o desfuncionalización ileal +
lavado exhaustivo y nueva LAPE sistemática en 48 horas de acurdo a criterios
de reintervención |
|
Fuente: Elaboración propia. |
||||
El objetivo de este nuevo
sistema de clasificación fue proporcionar una forma estandarizada para
permitir una estratificación del paciente más uniforme para dar pauta o guiar
el manejo óptimo según el estadio, lo cual se cumplió al obtener los resultados
estadísticos significativos. Por lo que esta publicación nos permite recomendar
el uso de esta clasificación que, además de ser clara en la definición de la
gravedad de la apendicitis aguda, se relaciona directamente con el grado de
contaminación de la cavidad peritoneal, daño de tejidos adyacentes y guía el manejo
quirúrgico conforme a los hallazgos transoperatorios. Ayuda a disminuir los
días de estancia hospitalaria, y por ende los costos, al prevenir las
complicaciones, guiarnos con los criterios generales y específicos del manejo
de cavidad para evitar, complicaciones, reintervenciones y mayor riesgo de
mortalidad. Facilita el proceso de sanación en la evolución del paciente, así
como el proceso de enseñanza-aprendizaje de los residentes de cirugía
Esta clasificación permite adaptar la técnica quirúrgica a la gravedad real del apéndice, lo que:
Reduce infecciones postoperatorias (hasta en 41 % vs manejos no clasificados).
Disminuye reintervenciones (≈ 10 % sin protocolo vs muy inferior).
Acorta estancia hospitalaria hasta en 200–300 % .
Otorga una guía precisa según lo observado en quirófano, a diferencia de clasificaciones tradicionales que solo distinguen entre "perforada" o "no perforada" .
✅ Aplicación práctica en quirófano
1. Estadio 1–2: inflamación leve o supurativa → apendicectomía laparoscópica + lavado local, posible drenaje.
2. Estadio 3: gangrenosa → lavado, considerar antibióticos más prolongados según hallazgos.
3. Estadio 4: perforada → lavado abundante de cavidad, drenaje en todos los casos.
. Estadio 5: absceso/plastrón → si se encuentra en cirugía, puede drenarse; otra opción es tratamiento conservador más apendicectomía diferida (semana a mes después).
🧭 Comparación con otras clasificaciones
A diferencia de la clasificación por fases tradicional (1 a 4), la propuesta de Hernández‑Orduña separa claramente el plastrón o absceso (estadio 5), lo cual tiene implicaciones sobre cuándo diferir o avanzar con cirugía .
Bibliografia
1. Addiss D., Shaffer N., Fowler B.S.,
et al: The epidemiology of appendicitis and appendectomy in the United
States. Am J Epidemiol 132. 910-925.1990
2.
Agrest A. El ocaso de la semiología.
Medicina (B Aires) 2008; 68: 175.
3.
Agrest A. Pasado, presente y futuro
en la enseñanza de la medicina clínica. En: Avances en medicina . Cámera
MI, Romani A, Madoery C, Farías J, editores, Buenos Aires: Sociedad Argentina
de Medicina; 1994, p 295-306
4. Ahn SH, Mayo-Smith WW, Murphy BL, et al. Acute
nontraumatic abdominal pain in adult patients: abdominal radiography compared
with CT evaluation. Radiology. 2002;225:159-64.
5. Akbulut S, Ulku A, Senol A, et al. Left-sided
appendicitis: review of 95 published cases and a case report. World J
Gastroenterol. 2010;16:5598-602.
6. Al-Mmran M., Mamdani M., McLeod
R.S.: Epidemiologic features of acute appendicitis in Ontario,
Canada. Can J Surg 46. 263-268.2003;
7.
Alvarado A. A practical score for the early diagnosis of acute
appendicitis. Ann Emerg med; 1986 15(5): 557-64
8.
Amyand C. Of an Inguinal Rupture, with a Pin in the
Appendix Coeci, Incrusted with Stone; And Some Observations on wounds in the
guts. Philos Trans R Soc Lond 1736; 39:
329-42.
9. Anderson SW, Soto JA, Lucey BC, et al. Abdominal 64-MDCT for suspected appendicitis:
the use of oral and IV contrast material versus IV contrast material only. AJR
Am J Roentgenol. 2009;193:1282-8.
10. Andersson R, Hugander A, Thulin A, Nyström PO,
Olaison G. Indications for operation in suspected appendicitis and incidence of
perforation. BMJ 1994;308:107-10.
11. Andersson Re, Hugander a, Ravn h, et
al. Repeated clinical and laboratory examinations in patients with an
equivocal diagnosis of appendicitis. World J Surg 2000; 24: 479-485.
12.
Andersson REB. Meta-analysis of the clinical and laboratory diagnosis of
appendicitis. Br J Surg 2004; 91: 28-37
13.
Antozzi MN, Zueedyk MJ: Apendicitis
perforada. En Cueto Cirugía Laparoscópica. 2ª ed, 218-20, 1988
14.
Archundia Archundia, 2013.Cirugia 2. Apendicitis Dr. Abel Archundia García
Mcgraw-Hill interamericana editores, s. a. de c. v.
15.
Arias AJ. Apendicitis. Experiencia
en el Hospital González Valencia. Rev Colomb Cir 1994; 9: 201-206.
16.
Ariza JG, Pestana-Tirado RA, Tatis
AM. Tumor carcinoide y endometriosis en apéndice cecal. Asociación curiosa.
Trib Méd 1997; 95: 282-291.
17.
Ashcraft,
2002. Cirugía pediátrica. 3ra edición.
Mc Graw Hill.
18.
Astroza G, Cortés C, Pizarro H,
Umaña M, Bravo M, Casas R. Diagnóstico clínico en apendicitis aguda. Rev Chil
Cir 2005; 57(4): 337-9.
19.
Astudillo R, et al. Apendicitis
aguda en el Hospital Vicente Corral Moscoso. Rev Colomb Cir 1988; 3: 103-108.
20. Athié G, Guízar B. Apendicitis. En: Tratado de Cirugía General. 2a edición. Editorial El Manual
Moderno, México. 2008:
753-61.
21.
Bailey H, Bishop W: Notable Names in Medicine and
Surgery. London, 43-45, 1959
22.
Bárbaro Agustín Armas Pérez,
Oliverio Agramonte Burón Gerardo Martínez Ferrá.
Apuntes históricos y fisiopatológicos sobre apendicitis. Revista Cubana de
Cirugía. 2019;58(1):e736
23. Barcat JA. Sobre la apendicitis aguda: Amyand, Fitz, y unos
pocos más. Medicina (B
Aires) 2010; 70: 576-8.
24. Barger RL Jr, Nandalur KR. Diagnostic
performance of magnetic resonance imaging in the detection of appendicitis in
adults: a meta-analysis. Acad Radiol. 2010;17:1211-6.
25. Bargy
F. Appendicite aiguë et péritonite. In: Helardot P, Bienaymé J, Bargy F,
editors. Chirurgie digestive de
l’enfant. Paris: Doin; 1990.p. 515-34.
26. Basaran A, Basaran M. Diagnosis of acute
appendicitis during pregnancy: a systematic review. Obstet Gynecol Surv.
2009;64:481-8.
27.
Beltrán
M, Villar R, Tapia T. Diagnóstico de apendicitis. Estudio prospectivo doble
ciego, no aleatorio. Rev Chil Cir 2004; 58(8): 550-7.
28.
Beltrán M, Villar R, Tapia TF, Cruces K.
Sintomatología atípica en 140 pacientes con apendicitis. Rev. Chilena de Cirug.
56 (3): 269 – 74 [seriada en Internet] 2004 Jun. [citado 15 de octubre de 2009]
;. Disponible en: http://www.cirujanosdechile.cl/Revista/PDF%20Cirujanos%202008_02/Cir.2_2008.( 13).pdf
29.
Beltrán MA, Almonacid FJ, Vicencio A,
Gutierrez J, Danilova T, Cruces KS. Rol del Recuento de Leucocitos y de la
proteína C reactiva en niños con apendicitis. Rev Chil Cir 2007; 1(59): 38-45
30. Benjamín IS, Patel AG. Managing
acute appendicitis. Br Med J 2002; 325: 505-506.
31. Berne TV, Ortega A: Apendicitis y absceso apendicular. En
Nyhus El Dominio de la Cirugía. 3ª ed, II: 1520-1524, 1999
32. Bernhard CM: Dr Ephraim McDowell:
father of abdominal surgery. Ann Surg 46:1-5, 1980
33. Bett WR: A Short History of Some
Common Diseases 162-171, 1934
34. Bhattacharya K. Kurt Semm: A
laparoscopic crusader. J Minim Access Surg 2007; 3: 35-6.
35.
Bianchi A, Heredia A, Hidalgo LA,
García F, Armella C, Suñol X. ¿Es suficiente la observación clínica en los casos dudosos de apendicitis? Emergencias
2005; 17:176-9.
36. Birnbaum BA, Wilson SR. Appendicitis
at the Millennium. Radiology 2000; 215: 337-48.
37. Bobrow B.J., Mohr J., Pollack , Jr ,
JrC.V.: An unusually complication of missed appendicitis. J Emerg
Med 14. 719-722.1996;
38. Bozola AR. Abdomen. Clasificación y análisis de los
tratamientos quirúrgicos. En: Coiffman F (eds.). Cirugía plástica
reconstructiva y estética, tomo IV, 2ª ed. Ediciones Científicas SA, 1994;
3086-3095.
39. Brennan GD. Pediatric appendicitis:
pathophysiology and appropriate use of diagnostic imaging. CJEM. 2006;8:425-32.
40. Bronner MP. Granulomatous appendicitis and the
appendix in idiopathic inflammatory bowel disease. Semin Diagn Pathol 2004;21: 98–107.
41. Brooks SM: McBurney’s Point The
Story of Appendicitis, 1959
42. Brown MA. Imaging acute appendicitis. Semin
Ultrasound CT MR. 2008;29:293- 307.
43.
Brunicardi,
2011. Schwartz, Principios de cirugía. 9na. Edición. Mc Graw Hill.
44. Buchman T.G., Zuidema G.D.:
Reasons for delay of diagnosis of acute appendicitis. Surg Gynecol Obstet
158. 260-266.1984;
45.
Butte B, Jean Michel, Bellolio A, M
Fernanda, Fernandez L, Francisca et al. Apendicectomía en la embarazada:
Experiencia en un hospital público chileno. Rev. méd. Chile. [online]. feb.
2006, vol.134, no.2 [citado 07 Abril 2008], p.145151. Disponible en la World
Wide Web: . ISSN 00349887.
46. Calzareto J: Patología apendicular. En Calzareto
Coloproctología Práctica. Clínica y cirugía. 1ª ed, 603-16, 1990
47.
Canales Solís PC. Comportamiento y manejo de la apendicitis aguda en pacientes de 60 años y
más en el Departamento de Cirugía General HEODRA, 2003 – 2006. [Tesis en Internet] Nicaragua: Universidad Autónoma de Nicaragua. Facultad de Ciencias Médicas. UNAMLeón; 2007 [citado 13 de julio de 2008];
Disponible en: http://www.minsa.gob.ni/bns/monografias/2007/cirugia/Apendicitis_aguda.pdf
48.
Carbonell,
2001. Hernia inguinocrural. Ethicon.
49.
Cárdenas GH. Etiología de la
apendicitis aguda. Es la posición anatómica un factor predisponerte. Rev Colomb
Cir 1992; 7: 34-37.
50. Cases Baldó MJ, Campillo Soto A, Mengual Ballester M, et al. Stump appendicitis: report of two cases and
review of literature. Rev Esp Enferm Dig. 2009;101:514-6.
51. Chalazonitis AN, Tzovara I, Sammouti E, et al.
CT in appendicitis. Diagn Interv Radiol. 2008;14:19-25.
52. Chapman J., Davies M., Wolff B., et
al: Complicated diverticulitis. Ann Surg 242. 576-581.2005;
53. Chong CF, Adi MI, Thien A, Suyoi A, Mackie AJ,
Tin AS, et al. Development of the RIPASA score: a new appendicitis scoring
system for the diagnosis of acute appendicitis. Singapore Med J 2010; 51: 220-225.
54. Chong CF, Thien A, Mackie AJ, Tin AS, Tripathi
S, Ahmad MA, et al. Comparison of RIPASA and Alvarado scores for the diagnosis
of acute appendicitis. Singapore Med J
2011; 52: 340-345.
55. Chow A, Purkayastha S, Paraskeva P:
Appendicectomy and cholecystectomy using single-incision laparoscopic surgery
(SILS): The first UK experience. Surg Innov 16:211-217, 2009.
56.
CMCG,
2008. Tratado de cirugía general. 2da. edición. Manual moderno
57.
Constantine,
2009. Atlas de cirugia minimamente invasia. 2009. Elsevier.Masson.
58. Cooperman M.: Complications of
appendectomy. Surg Clin North Am 63. 1233-1247.1983;
59. Cope Z. Apendicitis. En: Cope S. Diagnóstico precoz
del abdomen agudo. Marin editores, 12th ed. Barcelona: 1947, p
65-82.
60. Coursey CA, Nelson RC, Patel MB, et al. Making
the diagnosis of acute appendicitis: do more preoperative CT scans mean fewer
negative appendectomies? A 10- year study. Radiology. 2010;254:460-8.
61.
Crónica de la medicina. Anatomía
libre de restricciones, tomo III, Barcelona, Plaza y Janés Editores SA, 1993;
134.
62. Crosby WH, Haubrich WS: The death of
Walter Reed. JAMA 248:1342-45, 1982
63.
Cueto J, et al: Apendicectomía. En
Cirugía Laparoscópica de Cueto. 2ª ed, 213-18, 1998
64.
De Manzini N, et al: Apendicectomía.
En Cirugía Laparoscópica de Meinero 339-45, 1994
65.
Del Río Martín JV, Ashraf Memon M.
Justificación de la apendicectomía laparoscópica. Rev Esp Enferm Dig 1999; 91:
447-455.
66.
Departamento de Cirugía. Esc. Med.
Univ. Hab: Cirugía. Cuba. 2005, Tomo III, Cap. 13, p. 282-294.
67.
Diccionario Terminológico de Ciencias Médicas. Cuba.1995. Ver
maniobras, puntos y signos.
68.
Dolores Velásquez Mendoza. César Godínez
Rodríguez, Miguel Ángel Vásquez Guerrero. Evaluación prospectiva de la escala
de Alvarado en el diagnóstico de apendicitis aguda. Cirujano General 2010;
1(32): 17-23
69.
Duque CS, et al. Apendicitis causada
por cuerpo extraño. Rev Colom Cir 1990; 5: 12-3.
70. Ebell MH. Diagnosis of appendicitis: part 1.
History and physical examination. Am Fam Physician. 2008 Mar 15;77(6):828-30.
71.
Ellis H, Nathanson LK. Apéndice y
Apendicectomía. En: Zinder MJ, Schwartz SI, Ellis H (eds)., Maingot,
operaciones abdominales, tomo II, 10a. ed. Buenos Aires, Editorial Médica
Panamericana SA, 1998; 1107-1141.
72.
Ellis H. Incisiones, cierres y
manejo de la herida. En: Zinder MJ, Schwartz SI, Ellis H (eds.) Maingot
operaciones abdominales, tomo I, 10ª ed. Buenos Aires, Editorial Médica
Panamericana, 1998; 361-367.
73.
Elsevier 2014. Tratado de Cirugía del aparato
digestivo.
74. Emil S, Laberge JM, Mikhail P, Baican L,
Flageole H, Shaw K, et al. Appendicitis in children: a ten-year update of
therapeutic recommendations. J Pediatr
Surg 2003;38:236-42.
75. Eriksson S, Granström. Randomized controlled
trial of appendicectomy versus antibiotic therapy for acute
appendicitis. Br J Surg 1995; 82: 166-169.
76. Eshed I, Halshtok O, Erlich Z, et al.
Differentiation between right tubo-ovarian abscess and appendicitis using CT A
diagnostic challenge. Clin Radiol. 2011;66:1030-5.
77. Filiz AI, Aladag H, Akin ML, Sucullu I, Kurt Y, Yucel E, et al. The role of d-lactate in differential
diagnosis of acute appendicitis. J
Investigat Surg 2010; 23: 218-223.
78.
Finochieto E, Finochieto R:
Manipuleo del tubo gastrointestinal. En Finochieto, Técnica Quirúrgica 62-70,
1946
79. Fitz RH. Perforating inflammation of
the vermiform appendix; with special reference to its early diagnosis and treatment.
Am J Med Sci 1886; 92: 321-46.
80. Fitzgerald PG, Lau GY, Langer JC,
Cameron GS. Umbilical fold incision for pyloromyotomy. Pediatr Surg Int 1990;
25: 1117-1118.
81.
Fitzggibbons RJ, Ulualp KM:
Apendicectomía laparoscópica. En Nyhus, El Dominio de la Cirugía. 3ª ed, II:
1525-1532, 1999
82.
Florence M, Flum DR, Jurkovich GJ. Negative appendicectomy and imaging
accuracy in the Washington State Surgical Care and Outcomes Assessment Program.
Ann Surg 2008; 248: 557-63.
83. G Astroza E, C Cortés V, H Pizarro V. Diagnóstico clínico en
apendicitis aguda: una evaluación prospectiva. Rev Chilena de Cirugía. 2005; 4(57): 337-39
84.
Galindo,
2009. Cirugía Digestiva Patología quirúrgica del apéndice cecal. CASTAGNETO G;
, F. Galindo. www.sacd.org.ar, 2009; III-306, pág. 1-11.
85. Gendel I, Gutermacher M, Buklan G, Lazar L,
Kidron D, Paran H, et al. Relative value of clinical, laboratory and imaging
tools in diagnosing pediatric acute appendicitis. Eur J Pediatr Surg 2011; 21: 229-233.
86.
Gill RS, Shi X, Al-Adra DP, Birch DW, Karmali S. Single-incision
appendectomy is comparable to conventional laparoscopic appendectomy: A
systematic review and pooled analysis. Surg Laparosc
Endosc Percutan Tech 2012; 22: 319-327.
87. Gilo NB, Amini D, Landy HJ. Appendicitis and cholecystitis in pregnancy. Clin
Obstet Gynecol. 2009;52:586-96.
88.
Goldberg,
1992. Fundamentos de cirugía ano rectal. Noriega Limosa.
89. Gomes CC, Nunes TA, Fonseca JM, Junior CS, Gomes CC. Laparoscopy grading system of acute
appendicitis: new insight for future trials. Surg Laparosc Endosc Percutan
Tech 2012; 22: 463-466.
90.
GPC, 2014.
Asociación mexicana de cirugía
general a.c. Guía de práctica clínica apendicitis aguda México d.f. Octubre del 2014 asociación mexicana de cirugía general a.c. Comité
de elaboración de guías de práctica clínica
México d.f. Octubre del 2014
91. Groth D., Henderson S.O.:
Necrotizing fasciitis due to appendicitis. Am J Emerg Med 17.
594-596.1999;
92. Grozinsky-Glasberg S, Alexandraki KI, Barak D,
Doviner V, Reissman P, Kaltsas GA, et al. Current size criteria for the
management of neuroendocrine tumors of the appendix: are they valid? clinical
experience and review of the literature. Neuroendocrinology
2013;98:31–7.
93.
Gutiérrez
Samperio, 2006. Fisiopatología quirúrgica del aparato digestivo. 3ra. edición.
Manual Moderno.
94.
Gutiérrez Sánchez JO. Apendicitis en
el embarazo. Rev Cirugía; 2003. [serie en Internet] [citado 7 Abr
2008]. Disponible en:
http://encolombia.com/medicina/cirugia/cirugia18203-apendicitisenembarazo.htm
95. Guttman R, Goldman RD, Koren G. Appendicitis
during pregnancy. Can Fam Physician. 2004;50:355-7.
96.
Guzman, 2003. Una clasificación útil en
apendicitis aguda. Dr Gilberto Guzman del hospital general regional Numero 1 Gabriel Mancera del IMSS en Mexico.
Revista gastroenterología Mexico, Vol 68 Num
4, 2003.
97. Hale DA, Molloy M, Pearl RH, et al:
Appendectomy: A contemporary appraisal. Ann Surg 225:252, 1997.
98. Hansson J, Körner U, Khorram-Manesh A, Solberg
A, Lundholm K. Randomized clinical trial of antibiotic therapy versus appendicectomy
as primary treatment of acute appendicitis in unselected patients. Br J Surg
2009; 96: 473-481.
99. Harris CW: Abraham Groves of Fergus;
the first elective appendicectomy?. Can J Surg 4: 405-10, 1961
100. HAS. Appendicectomie. Eléments décisionnels
pour une indication pertinente. www.sfmu.org/documents/consensus/ ret
appendicectomie 2012.pdf.
101. Hatch El, Naffis D. Chandler NW: Pitfalls in
the use of harium enema in early appendicitis in children. J Pediatr Surg
16:309-312, 1981.
102. Hay JM, Flamant Y, A.R.C., A.U.R.C.
Appendicite. Rev Prat 1992;42:669–715.
103.
Hay, 1992. Hay J.M.,
Flamant Y., A.R.C., A.U.R.C. Appendicite Rev Prat 1992 ; 42 : 669-715 Maingot-Zinner. Operaciones abdominales.
11 va. edición Panamericana
104. Hekimoglu K, Yildirim UM, Karabulut E, et al.
Comparison of combined oral and i.v. contrast-enhanced versus single i.v.
contrast-enhanced mdct for the detection of acute appendicitis. JBR-BTR.
2011;94:278-82.
105. Hennelly KE, Bachur R. Appendicitis update.
Curr Opin Pediatr. 2011;23:281-5.
106.
Hernández-Orduña
Juan. Clasificación práctica de la gravedad y manejo médico-quirúrgico de la
apendicitis aguda. Cir Gen. 2020; 42 (4): 263-273. https://dx.doi.org/10.35366/101395
107.
Hernandez-Orduña Juan. Escala de
mayor precisión para el diagnóstico de apendicitis aguda: análisis comparativo
entre la escala de Alvarado, RIPASA y nueva propuesta. Cirujano
Julio-septiembre 2019 Vol. 41, núm. 3 / p. 144-156.
108. Hernanz-Schulman M. CT and US in the diagnosis
of appendicitis: an argument for CT. Radiology. 2010;255:3-7.
109. Hlibczuk V, Dattaro JA, Jin Z, et al. Diagnostic accuracy of noncontrast computed
tomography for appendicitis in adults: a systematic review. Ann Emerg Med.
2010;55:51-59.
110. Hopkins CL, Madsen T, Foy Z, et al. Does
limiting oral contrast decrease emergency department length of stay? West J
Emerg Med. 2012;13:383-7.
111. Howell JM, Eddy OL, Lukens TW, et al. Clinical
policy: Critical issues in the evaluation and management of emergency
department patients with suspected appendicitis. Ann Emerg Med. 2010;55:71-116.
112. Humes DJ, Simpson J. Clinical presentation of
acute appendicitis: clinical signs–laboratory fi ndings–clinical scores,
Alvarado score and derivate scores. Imaging of acute appendicitis in adults and
children. Medical Radiology 2011:
13-21. DOI: 10.1007/174_2011_211.
113. Ilves I, Paajanen HE, Herzig KH, Fagerström A,
Miettinen PJ. Changing Incidence of Acute Appendicitis and Nonspecifi c
Abdominal Pain Between 1987 and 2007 in Finland. World J Surg 2011; 35: 731-738.
114. INEGI, 2009. Anuario Estadístico de los Estados Unidos Mexicanos.
2009.
115. Ishigami K., Khanna G., Samuel I.,
et al: Gas-forming abdominal wall abscess: unusual manifestation of
perforated retroperitoneal appendicitis extending through the superior lumbar
triangle. Emerg Radiol 10. 207-209.2004;
116. Jardin DM. Acute appendicitis:
review and update. Am Fam Physician 1999; 60: 2027-2034.
117. Jones PF. Suspected acute appendicitis: trends
in management over 30 years. Br J Surg
2001;88:1570-7.
118.
José Luis Leyba, Carlos Bravo, Alejandra
Dehollain, José Isaac. Proteína C reactiva y apendicitis aguda. Gac Méd
Caracas 2006; 1(114): 17-21
119.
Kailash Singh, Shyam Gupta, Pinki Pargal. Application of Alvarado
Scoring System in Diagnosis of Acute Appendicitis. JK Science. 2008; 2(10): 84-86
120. Karmali MA, Toma S, Schiemann DA, et al:
Infection caused by Yersinia enterocolitica serotype 0:21. J Clin Microbiol
15:596-598, 1982.
121. Kaya B, Sana B, Eris C, Karabulut K, Bat O,
Kutanis R. The diagnostic value of D-dimer, procalcitonin and CRP in acute
appendicitis. Int J Med Sci 2012; 9: 909-915.
122. Kearney D, Cahill R, O Brien E, Kirwan W,
Redmond H, Influence of delays on perforation risk in adults with acute
appendicitis. Dis Colon Rectum 2008;51: 1823-27
123. Kelly HA, Humden E: The Vermiform Appendix.
Philadel- phia, WB Saunders, 1905.
124. Kessler N, Cyteval C, Gallix B, et al.
Appendicitis: evaluation of sensitivity, specificity, and predictive values of
US, Doppler US, and laboratory findings. Radiology. 2004;230:472-8
125. Kim HC, Yang DM, Lee CM, et al. Acute
appendicitis: relationships between CTdetermined severities and serum white
blood cell counts and C-reactive protein levels. Br J Radiol. 2011;84:1115-20.
126. Kim K, Kim YH, Kim SY, et al. Low-dose
abdominal CT for evaluating suspected appendicitis. N Engl J Med.
2012;366:1596-605.
127. Kim SW, Shin HC, Kim IY, et al. CT findings of
colonic complications associated with colon cancer. Korean J Radiol.
2010;11:211-21.
128. Kim SY, Lee KH, Kim K, et al. Acute
appendicitis in young adults: low- versus standard-radiation-dose
contrast-enhanced abdominal CT for diagnosis. Radiology. 2011;260:437-45.
129. Klabtawee W, Saensak W, Khetsoongnern A,
Piriyasupong T. Accuracy of RIPASA and modifi ed RIPASA score comparing with
Alvarado score for diagnosis of acute appendicitis and complication of acute
appendicitis. Khon Kaen Medical
Journal 2011; 35: 38-47
130.
Korn O. Apendicitis aguda sin dolor
o "El paraíso de los tontos". Caso clínico. Rev Med Chile 2008; 136:
1559-63.
131. Kosaka N, Sagoh T, Uematsu H, et al.
Difficulties in the diagnosis of appendicitis: review of CT and US images.
Emerg Radiol. 2007;14:289-95.
132. Krajewski S, Brown J, Phang PT, et al. Impact
of computed tomography of the abdomen on clinical outcomes in patients with
acute right lower quadrant pain: a meta-analysis. Can J Surg. 2011;54:43-53.
133. Krishnamoorthi R, Ramarajan N, Wang NE, et al.
Effectiveness of a staged US and CT protocol for the diagnosis of pediatric
appendicitis: reducing radiation exposure in the age of ALARA. Radiology.
2011;259:231-9.
134. Lam M, Singh A, Kaewlai R, et al. Magnetic
resonance of acute appendicitis: pearls and pitfalls. Curr Probl Diagn Radiol.
2008;37:57-66.
135. Laméris W, Van Randen A, Go PM, Bouma WH,
Donkervoort SC, Bossuyt PM, et al. Single and combined diagnostic value of
clinical features and laboratory tests in acute appendicitis. Acad Emerg Med 2009; 16: 835-842.
136. Levine CD, Aizenstein O, Wachsberg RH.
Pitfalls in the CT diagnosis of appendicitis. Br J Radiol. 2004;77:792-9.
137. Lewis F: Appendix, in Davis JH (ed): Clinical
Surgery, 1st ed, vol. 1. St. Louis, Mo: Mosby, 1987, p 1581.
138. Lin YY, Tsai SH, Chu SJ. Abdominal
wall abscess in a diabetic patient with ruptured appendicitis. J Trauma (in
press).
139. Lindskog GE: Guillaume Dupuytren,
1777 to 1835. Surg Gynecol Obstet 145:746-54, 1977
140. Livingston EH, Woodward WA, Sarosi GA, Haley
RW. Disconnect between incidence of nonperforated and perforated appendicitis.
Implications for pathophysiology and management. Ann Surg 2007;245:886–92.
141.
Llanio Navarro, R. Propedéutica
Clínica y Fisiopatología. Edit. Pueblo y Educación.Cuba.2004 Tomo II, p. 594-596
142.
Londoño E, Vega NV. Pseudomixoma
peritoneal de origen apendicular. Informe de un caso y revisión de la
literatura. Rev Colomb Cir 1995; 10: 51-53.
143.
Lucas Canavosso, Pablo Carena, Juan Manuel
Carbonell. Dolor en fosa iliaca derecha y Score de Alvarado. Cir Esp. 2008;
83(5): 247-51
144. Ma KW, Chia NH, Yeung HW, et al. If not
appendicitis, then what else can it be? A retrospective review of 1492
appendectomies. Hong Kong Med J. 2010;16:12-7.
145.
Maingot-Zinner.
2007. Operaciones abdominales. 11 va.
Edición. Mc Graw Hill.
146.
Mandell, 2012.
Enfermedades infecciosas en
pacientes quirúrgicos GERALD L. MANDELL, MD, MACP JOHN E. BENNETT, MD, MACP
RAPHAEL DOLIN, MD s é p t i m a e d i c i ó n 2012 Elsevier España Barcelona,
España
147.
Marañón G. Abdomen Agudo. En: Manual
de Diagnóstico Etiológico. Espasa-Calpe, editores, 5ª ed. Madrid:
1950, P 239-53.
148.
Marcelo A Beltrán, Raúl Villar M, Karina S
Cruces. Puntuación diagnóstica para apendicitis: Estudio prospectivo de su
aplicación por profesionales de la salud no médicos. Rev Méd Chile 2006; 134:
39-47
149.
Marulanda S, et al. Cirugía biliar
por minilaparotomía mediana subxifoidea. Rev Colomb Gastroenterol 1995; 10:
112-123.
150.
Mcade RH: The evolution of surgery for appendicitis. Surgery 55: 741-52, 1964
151.
McAnena OJ, Boyle TJ. Apendicectomía
laparoscópica. Cir Laparosc Sem 1995; 2: 36-45.
152. McBurney C: Experience with early operative
interference in cases of disease of the vermiform appendix. N Y State Med J 50:676,
1889.
153. McBurney C: The incision made in the abdominal
wall in cases of appendicitis. Ann Surg 20:38, 1894.
154.
Medrano Plana Y, Portal Benítez LN,
Parrilla Arias F. Correlación clínicopatológica de la apendicitis aguda.
[página en Internet] 2004 [citado 15 de octubre de 2009] ; Disponible en:
http://www.sc.ehu.es/scrwwwsr/kirurgia/Kirurgia20043/Apendicitis.htm
155. Meier DE, Guzzetta PC, Barber RG, Hynan LS,
Seetharamaiah R. Perforated appendicitis in children: is there a best
treatment? J Pediatr Surg 2003;38:1520-4.
156. Meinke A. Review article: appendicitis in
groin hernias. J Gastrointest Surg. 2007;11:1368-72.
157.
Mel Wilcox C. Enfermedades inflamatorias diversas del intestino. E: Goldman L. Bennet
C. Tratado de medicina interna Cecil. Vol 1. 21 ed. Madrid: Mc grawHill
Interamericana, 2000. p. 80518.
158.
Michael
Henry. 2005. Cirugía clínica. Masson.
159.
Michans,
2008. Cirugía. 5ta edición. Editorial el Ateneo.
160.
Misiewicz,
1995. Atlas de gastroenterología clínica. Mossby.
161.
Moore KL. Anatomía orientación
clínica. Buenos Aires. Editorial Médica Panamericana 1982; 222-224.
162.
Moore L. Embriología clínica. Buenos
Aires, Interamericana 1989.
163.
Moreno LR. Manejo ambulatorio en
pacientes pediátricos apendicectomizados. XIV Congreso Panamericano de Cirugía
Pediátrica, IV Congreso Cubano de Cirugía Pediátrica, III Jornada
Hispanoamericana de Cirugía Pediátrica La Habana, Cuba, octubre 17-21, 1994.
164. Naeger DM, Chang SD, Kolli P, et al. Neutral
vs positive oral contrast in diagnosing acute appendicitis with
contrast-enhanced CT: sensitivity, specificity, reader confidence and
interpretation time. Br J Radiol. 2011;84:418-26.
165.
Neill,
1998. Pediatric Surgery. 5ta edición.
Mosby
166. Neilson IR, Laberge JM, Nguyen LT, et al. Appendicitis in children: current
therapeutic recommendations. J Pediatr Surg 1990; 25: 1113-1116.
167. Noh H, Chang SJ, Han A. The diagnostic values
of preoperative laboratory markers in children with complicated appendicitis. J
Korean Surg Soc 2012; 83: 237-241.
168. Noh H, Chang SJ, Han A. The diagnostic values
of preoperative laboratory markers in children with complicated appendicitis. J
Korean Surg Soc 2012; 83: 237-241.
169.
Normas de Cirugía.Cuba.1889. P. 462-463; 516-522.
170.
Nyhus,
1996. Dolor abdominal. Editorial paramericana
171. Ocampo C. Apéndice cecal. En: Ferraina P, Oria A. Cirugía
de Michans. El Ateneo editores, Buenos Aires: 1997, p 806-15
172. Ohle R, O’Reilly F, O’Brien KK, et al. The
Alvarado score for predicting acute appendicitis: a systematic review. BMC Med.
2011;9:139.
173. Old JL, Dusing RW, Yap W, et al. Imaging for
suspected appendicitis. Am Fam Physician. 2005;71:71-8.
174.
Oner Mentes, Mehmet Eryılmaz, Ali Harlak. The importance of urine
5-hydroxyindoleacetic acid levels in the early diagnosis of acute appendicitis.
American Journal of Emergency Medicine (2009) 27, 409–412
175.
Osorio E: Harvey Cushing a la
búsqueda de Vesalio. Diálogo 2 (1): 6-20, 1992
176.
Padierna-Luna JL, Ruiz-Valenzuela KL, Morales
Arellano AC. Proteina C Reactiva en el diagnóstico de apendicitis aguda. Rev
Mex Patol Clin 2005; 52(3): 163-67
177. Palanivelu C, Rajan PS, Rangarajan M, et al:
Transvaginal endoscopic appendectomy in humans: A unique approach to
NOTES—world’s first report. Surg Endosc 22:1343-1347, 2008.
178. Paris CA, Klein EJ. Abdominal pain in children
and the diagnosis of appendicitis. West J Med. 2002;176:104-7.
179. Parks NA, Schroeppel TJ. Update on imaging for
acute appendicitis. Surg Clin North Am. 2011;91:141-54.
180.
Parodi Zambrano F. Apendicitis
aguda. [monografía en Internet] 2007 [citado 20 de abril de 2009] ; Disponible
en: http://www.medicosecuador.com/espanol/especialidades/cirugia_general.htm
181.
Parodi,
2016. Relato Histórico Dr. Francisco Parodi Zambranohttp://www.medicosecuador.com/librosecng/articuloss/3/apendicitis_aguda.htm
182.
Parrilla Paricio P, Garcia Vadecasa
Salgado JC, Targarona Soler EM. Abdomen agudo. En: Farreras Valenti P, Rosean
C. Medicina Interna. Vol 1. 14 ed. Madrid: Harcourt, 2000. p. 191-204.
183. Patel SJ, Reede DL, Katz DS, et al. Imaging the pregnant patient for nonobstetric
conditions: algorithms and radiation dose considerations. Radiographics.
2007;27:1705-22.
184. Paulson EK, Harris JP, Jaffe TA, et al. Acute
appendicitis: added diagnostic value of coronal reformations from isotropic
voxels at multi-detector row CT. Radiology. 2005;235:879-85.
185. Paulson EK, Kalady MF, Papps TN.
Suspected Appendicitis. N Engl J Med 2003; 348: 236-42.
186. Pereira JM, Sirlin CB, Pinto PS, et al. Disproportionate fat stranding: a helpful CT
sign in patients with acute abdominal pain. Radiographics. 2004;24:703-15.
187. Pestana-Tirado RA, Ariza GJ, Oviedo LI, Moreno LR.
Apendicitis aguda. El diagnóstico es clínico. Trib Méd 1997; 96: 282-296.
188.
Pestana-Tirado RA, Ariza GJ, Oviedo
LI, Moreno LR. Ventajas del manejo ambulatorio del postoperatorio de pacientes
adultos apendicectomizados. XXI Congreso Nacional “Avances en Cirugía”, Foro
Quirúrgico Colombiano. Santafé de Bogotá, agosto15-18, 1995.
189.
Pestana-Tirado RA, Moreno LR.
Apendicectomía transumbilical. Un nuevo abordaje quirúrgico. XXVII Congreso
Nacional “Avances en Cirugía”, Sociedad Colombiana de Cirugía. Santafé de
Bogotá, DC. agosto 21-24, 2001.
190.
Pestana-Tirado RA, Moreno LR.
Apendicectomía transumbilical. Una técnica depurada y competitiva. XXVIII
Congreso Nacional “Avances en Cirugía”, Sociedad Colombiana de Cirugía.
Cartagena de Indias DT y C, agosto 27-30, 2002.
191. Petroianu A, Alberti LR. Accuracy of the new
radiographic sign of fecal loading in the cecum for differential diagnosis of
acute appendicitis in comparison with other inflammatory diseases of right
abdomen: a prospective study. J Med Life. 2012;5:85-91.
192. Pieper R, Kager L. The incidente of
acute appendicitis and appendectomy: an epidemiological study of 971 cases.
Acta Chir Scand 1982; 148: 45-51
193.
Pinilla González, R. et al.:
Valoración de algunos aspectos según estudio evolutivo de la apendicitis aguda.
Rev Cubana Cir 26 (6): 2131, 2001.
194. Pittman VA, Myer JG, Stewart RM, et
al. Appendicitis: Why so complicated? Analysis of 5.755 consecutive
appendicectomies. Am J Surg 2000; 66: 548-554.
195. Prystowsky J.B., Pugh C.M., Nagle
A.P.: Current problems in surgery. AppendicitisCurr Probl Surg 42.
688-742.2005;
196. Purysko AS, Remer EM, Filho HM, et al. Beyond
appendicitis: common and uncommon gastrointestinal causes of right lower
quadrant abdominal pain at multidetector
CT. Radiographics. 2011;31:927-47.
197.
Quintero,
2001. Infección en cirugía. Editoral panamericana
198. Raja AS, Wright C, Sodickson AD, et al.
Negative appendectomy rate in the era of CT: an 18-year perspective. Radiology.
2010;256:460-5.
199.
Ramírez MA. El ombligo. Situación e
importancia. Minidermolipectomía. En: Coiffman F, (eds.). Cirugía plástica
reconstructiva y estética, tomo IV, 2ª ed. Ediciones Científicas SA, 1994;
3112-3116
200.
Rao PM, Rhea JT, Rao JA, et al. Plain abdominal radiography in
clinically suspected appendicitis: diagnostic yield, resource use, and
comparison with CT. Am J Emerg Med. 1999;17:325-8.
201.
Raysy Sardiñas Ponce. Obel Alcides
Guerra Leal. Las hernias de Amyand y Garengeot como expresión del apéndice
cecal. Revista Cubana de Cirugía. 2019;58(4):e776
202.
Robert McKay MD, Jessica Shepherd DO. The use of the clinical scoring
system by Alvarado in the decision to perform computed tomography for acute
appendicitis in the ED. American Journal of Emergency Medicine (2007)
25, 489–493.
203.
Robles,
1996 Nutrición en el paciente críticamente enfermo. Mc Graw Hill.
204.
Rock,
1998. Te Linde. Ginecología quirúrgica. 8va edición. Panamericana
205.
Rodríguez-Loeches Fernández, J.
Características Clínicas y diagnóstico del Abdomen Agudo. Edit.
Científico-Técnica, La Habana, 1993. p.57-68
206.
Rodríguez-Loeches Fernández, J.
Características Clínicas y diagnóstico del Abdomen Agudo. Edit.
Científico-Técnica, La Habana, 1993. p.57-68
207. Roma Hernández MD, Ashok Jain MD, Lucas Rosiere. A prospective clinical trial evaluating
urinary 5-hydroxyindoleacetic acid levels in the diagnosis of acute
appendicitis. American Journal of Emergency Medicine (2008)
26, 282–286
208. Rybkin AV, Thoeni RF. Current concepts in
imaging of appendicitis. Radiol Clin North Am. 2007;45:411-22, vii.
209.
Sabiston D. Appendicitis. En Sabiston
(Editor).Textbook of Surgery.P hiladelphia. WB
Saunders.1997 págs. 964-970.
210.
Sabiston,
2013. Tratado de cirugía. 19ava edición.
Elsevier.
211.
Sackier JM. Laparoscopia en
apendicitis aguda. Cir Laparosc Sem 1996; 3: 61-68.
212. Sadousky R. Diagnosis of acute
appendicitis in children. Am Fam Phisician 2001; 63: 343-4.
213. Sakorafas GH, Sabanis D, Lappas C, Mastoraki
A, Papanikolaou J, Siristatidis C, et al. Interval routine appendectomy
following conservative treatment of acute appendicitis: is it really needed? World
J Gastrointest Surg 2012; 4: 83-86.
214.
Sanabria A, Henao C, Bonilla R, et
al. Diagnóstico de apendicitis aguda en un centro de referencia. Un enfoque
basado en la evidencia. Rev Colomb Cir 2000; 15: 147- 154.
215. Schwartz D. Imaging of suspected appendicitis:
appropriateness of various imaging modalities. Pediatr Ann. 2008;37:433-8.
216. Seal A: Apendicitis: a historical
review. Can J Surg 24: 427-433, 1981
217. See TC, Watson CJ, Arends MJ, et al. Atypical
appendicitis: the impact of CT and its management. J Med Imaging Radiat Oncol.
2008;52:140-7.
218. Semm K: Endoscopic appendectomy. Endoscopy 15:59,
1983.
219. Shepherd JA: Acute apendicitis a
historical survey. Lancet 2: 299-302, 1954
220. Sieren LM, Collins JN, Weireter LJ, Britt RC,
Reed SF, Novosel TJ, et al. The incidence of benign and malignant neoplasia
presenting as acute appendicitis. Am
Surg 2010; 76: 808-811.
221.
Silen W. Apendicitis aguda. En:
Braunwuald E, Farsi AS, Kasper DL, Hauser SL, Longo D, Jameson JL. Principios de medicina interna Harrison. Vol 2. 15 ed. Madrid: Mc Graw Hill, 2002. p. 19924.
222. Silver, 2013. Módulo x. temas de actualidad en cirugía. Dr. Enrique
Jean Silver, Dr. Jorge Ortiz de la Peña, FACS. Cirujano General Vol. 35
Supl. 1 – 2013 Volumen 35, Supl. 1 Enero-Marzo 2013 S73 Este artículo puede ser
consultado en versión completa en: http://www.medigraphic.com/cirujanogeneral
223. Singh A, Danrad R, Hahn PF, et al. MR imaging
of the acute abdomen and pelvis: acute appendicitis and beyond. Radiographics.
2007;27:1419-31.
224. Sivit CJ, Siegel MJ, Applegate KE, et al. When
appendicitis is suspected in children. Radiographics. 2001;21:247-62.
225. Snelling C, Poenaru D, Drover J. Minimum
postoperative antibiotic duration in advanced appendicitis in children: a
review. Pediatr Surg Int 2004;20:838-45.
226.
Soler,
2010. Apendicitis aguda Cirugia del
abdomen. Abdomen agudo y lesiones traumáticas abdominales. Soler Vaillant,
Rómulo-La Habana: Editorial Ciencias Médicas, 2010. Capitulo 4
227. Spalluto LB, Woodfield CA, DeBenedectis CM, et
al. MR imaging evaluation of abdominal pain during pregnancy: appendicitis and
other nonobstetric causes. Radiographics. 2012;32:317-34.
228. Stengel JW, Webb EM, Poder L, et al. Acute appendicitis: clinical outcome in
patients with an initial false-positive CT diagnosis. Radiology.
2010;256:119-26.
229. Stoker J, van Randen A, Laméris W, et al.
Imaging patients with acute abdominal pain. Radiology. 2009;253:31-46.
230. Stoopen, 1998.Radiología
e imagen diagnóstica y terapéutica. Abdomen Tomo
I. Editorial Lippincott.
231. Storm-Dickerson T.L., Horattas
M.C.: What have we learned over the past 20 years about appendicitis in
the elderly?. Am J Surg 185. 198-201.2003;
232. Strouse P. Pediatric appendicitis: an argument
for US. Radiology. 2010;255:8-13.
233. Styrud J, Eriksson S, Nilsson I, Ahlberg G,
Haapaniemi S, Neovius G, et al. Appendectomy versus antibiotic treatment
in acute appendicitis, a prospective multicenter randomized controlled trial. World
J Surg 2006; 30: 1033-1037.
234. Styrud J, Eriksson S, Nilsson I, Ahlberg G,
Haapaniemi S, Neovius G, et al. Appendectomy versus antibiotic treatment
in acute appendicitis, a prospective multicenter randomized controlled trial. World
J Surg 2006; 30: 1033-1037.
235. Sugarbaker PH. Epithelial appendiceal
neoplasms. Cancer J 2009;15:225–35.
236. Suh SW, Choi YS, Park JM, et al. Clinical
factors for distinguishing perforated from nonperforated appendicitis: a
comparison using multidetector computed tomography in 528 laparoscopic
appendectomies. Surg Laparosc Endosc Percutan Tech. 2011;21:72-5.
237.
Suros,
2002.Semiología médica y técnica exploratoria. 8va edición. Elsevier -Masson.
238. Tan KC, Bianchi A. Circumbilical
incision for pyloromyotomy. Br J Surg 1986; 73: 399.
239.
Telford GL, Condon R: Apéndice. En
Zuidema Cirugía del Aparato Digestivo. 3ª ed, IV: 166-177, 1993
240.
Telford GL, Condon RE. Apéndice. En:
Zuidema GD. Shackelfor, cirugía del aparato digestivo, tomo IV, 3ª ed. Buenos
Aires: Editorial Médica Panamericana SA, 1993; 166-167.
241.
Temple KF, Litwin DE, McLeod RS. A meta-analysis of laparoscopic open
appendectomy in patients suspected of having acute appendicitis. Can J Surg 1999; 42: 377-342.
242.
Testut L, Latarjet A. Tratado de
anatomía humana, tomo I, 9ª ed. Barcelona, Salvat Editores 1978; 965-968.
243.
Testut-Latarget,
1994.Anatomía Humana. Salvat.
244. Thésaurus National de Cancérologie Digestive. Tumeurs endocrines digestives.
www.snfge.org/data/ModuleDocument/publication/ 5/pdf/TNCD-chapitre-1252.pdf.
245.
Thompson JD: El apéndice vermiforme
en relación con la ginecología. En Te Linde. 7ª ed, 907-920, 1993
246.
Thuijls G, Derikx JP, Prakken FJ, Huisman B,
van Bijnen Ing AA, van Heurn EL, et al. A pilot study on potential new plasma markers
for diagnosis of acute appendicitis. Am J Emerg Med 2011; 29: 256-260.
247. Treves F. Relapsing typhlitis
treated by operation. Med Chir Trans 1888; 71: 165-72.
248.
Trott,
2007. Heridas y cortes. Tratamiento y sutura de urgencia. 3ra edición.
Elsevier.
249.
Trujillo, 2015. Score
de alvarado modificado en el diagnóstico
de apendicitis aguda en adultos Yeray Trujillo
y Carlos Contreras. Revista Médica Carrionica.2015;2 (1):
12
250.
Valenzuela,
1997.Gastroenterología y hepatología. Mediterráneo
251.
Vallejo Witowsha, R. et al.: Abdomen
agudo en el paciente geriátrico. Rev Cubana Cir 22 (4): 326337, 2003.
252.
Vallejo Witowsha, R. et al.: Abdomen
agudo en el paciente geriátrico. Rev Cubana Cir 22 (4): 326337, 2003.
253. van Randen A, Bipat S, Zwinderman AH, et al.
Acute appendicitis: meta-analysis of diagnostic performance of CT and graded
compression US related to prevalence of disease. Radiology. 2008;249:97-106.
254. Varadhan KK, Humes DJ, Neal KR, Lobo DN.
Antibiotic therapy versus appendectomy
for acute appendicitis: a meta-analysis. World
J Surg 2010; 34: 199-209.
255. Varadhan KK, Neal KR, Lobo DN. Safety and effi
cacy of antibiotics compared with appendicectomy for treatment of uncomplicated
acute appendicitis: meta-analysis of randomized controlled trials. BMJ 2012;
344: e2156.
256.
Vázquez Ronco MA, Morteruel
Arizkuren E, García Ojeda E, Mintegui Raso S, Canapé Zache S, Benito Fernández
J. Diagnóstico de apendicitis aguda. An Esp Pediatr 2003; 58: 556-61.
257.
Vélez JP, Corrales A, Vásquez J,
Herrera A. Apendicectomía ambulatoria. Rev Colomb Cir 1997; 12: 29-32.
258. Verdugo R, Olave E. Características anatómicas y biométricas del
apéndice vermiforme en niños chilenos operados por apendicitis aguda. Int J Morphol. 2010;28:615-22.
259. Vons C, Barry C, Maitre S, Pautrat K, Lecante
M, Costaglioli B, et al. Amoxicillin plus clavulanic acid versus appendicectomy
for treatment of acute uncomplicated appendicitis: an open-label,
non-inferiority, randomised controlled trial. Lancet 2011;377:1573–9.
260.
Waisman H, Gutiérrez D. Apendicitis
aguda. En: Waisman H, Gutiérrez D. Abdomen Agudo. EDIMED editores,
Buenos Aires: 1984, p 42-8.
261.
Way,
2007.Diagnóstico y tratamiento quirúrgicos.
Manual moderno.
262.
Williams GR. Presidential address: a history of
apendicitis. With anecdotes illustrating its importance. Ann Surg 1983; 197: 495-506.
263. Williams R, Shaw J. Ultrasound scanning in the
diagnosis of acute appendicitis in pregnancy. Emerg Med J. 2007;24:359-60.
264. Wilms IM, de Hoog DE, de Visser DC, Janzing
HM. Appendectomy versus antibiotic treatment for acute appendicitis. Cochrane
Database Syst Rev 2011; 11: 1-CD008359.
265.
Wolfe,
2001.Terapéutica de los trastornos digestivos. Mc Graw Hill.
266.
Wong Pujada P, Morón Antonio P,
Espino Vega C, Arévalo Torres J, Villaseca Carrasco R. Apendicitis aguda. [monografía en Internet] 2008 [citado 18 de julio de 2009] ; Disponible en: http://sisbib.unmsm.edu.pe/bibvirtual/libros/Medicina/cirugia/Tomo_I/Cap_11_Apen dicitis%20aguda.htm
267. Yang HR, Wang YC, Chung PK, Chen WK, Jeng LB,
Chen RJ. Laboratory tests in patients with acute appendicitis. ANZ J Surg 2006; 76: 71-74.
268. Yotsuyanagi T, Nihei Y, Sawada Y. A
simple technique for reconstruction of the umbilicus using two twisted flaps.
Plast Reconstr Surg 1998; 102: 244-246.
269.
Zaldivar-Ramirez,
2012. Precisión diagnóstica de la escala RIPASA para el diagnóstico de
apendicitis aguda: análisis comparativo con la escala de Alvarado modificada
Servicio de Cirugía General, Hospital General
de México. Cirujano General Vol. 34 Núm. 2 – 2012
270.
Zamora Godínez J, Jiménez Chavarría E, Zamora
Godínez R. Diagnóstico y tratamiento de la apendicitis aguda: retos y problemas
actuales del cirujano. En: Asociación Mexicana de Cirugía General, A. C.;
Noyola Villalobos HF, Magaña Sánchez IJ, coordinadores. PROACI Programa de
Actualización en Cirugía: Ciclo 2. Ciudad de México: Artmed Panamericana; 2018.
p. 61-89 (Sistema de Educación Continua a Distancia, v. 3).
271.
Zuidema-Shackelford.
2013. Cirugía del aparato digestivo. 6ta edición. Elsevier.




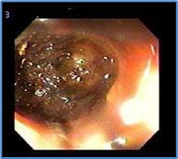


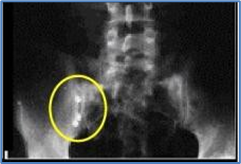





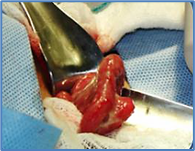
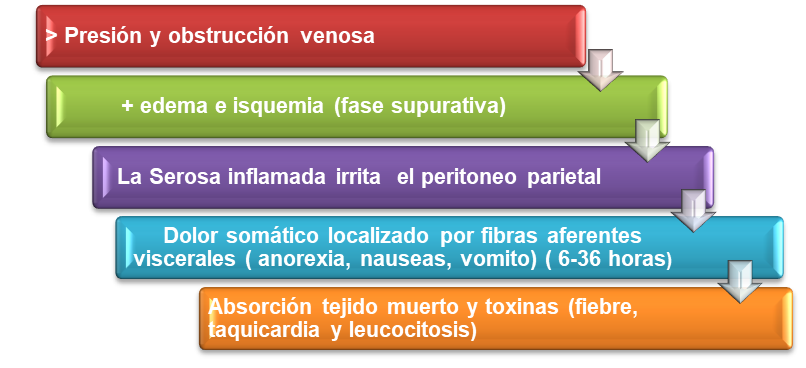
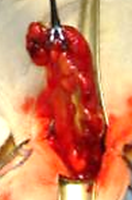
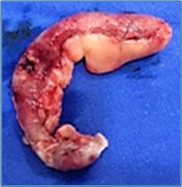


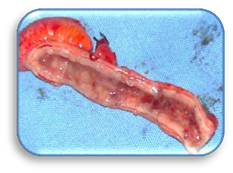

No hay comentarios.:
Publicar un comentario