Colecistitis aguda o escleroatrófica mayor
La colecistitis
aguda o escleroatrófica se asocia
con
un determinado número de dificultades quirúrgicas adicionales, relacionadas con procesos inflamatorios o fibróticos locales, lo cual supone tomar ciertas
precauciones especiales en todas las fases
de la disección quirúrgica.
Puntos clave en caso de colecistitis aguda o Colecistectomía en los 4 días siguientes al inicio del episodio
agudo.
o
Descompresión mediante punción de la vesícula
con
aguja de Veress. o Suspensión del ligamento redondo y/o el trocar
n. O 5, si es necesario.
o
Casos difíciles (Calot indisecable): vía anterógrada y/o endovesicular (v. apartado "Colecistectomía subtotal,).
o
Saco de extracción sistemático (aumento de tamaño del
orificio de extracción).
Colecistitis aguda diferida
Varios estudios retrospectivos o aleatorios (Navez, 2001. Kiviluoto, 1998) han demostrado que una intervención laparoscópica precoz (en los 4 días siguientes al inicio del episodio agudo) se asocia con una tasa menor de conversiones en laparotomía y de complicaciones postoperatorias, en comparación con una cirugía diferida después de un tratamiento médico con antibióticos. Cuanto más pronto se interviene quirúrgicamente la colecistitis aguda en la evolución del proceso inflamatorio, más se facilita la disección
debido al edema. En caso de poca experiencia del cirujano
se requiere con frecuencia la conversión a una laparotomía, como sucede en
caso de colecistitis gangrenosa, incluso
para un cirujano experimentado.
Un
factor notable
de
dificultades quirúrgicas independientemente
de
la
demora es la presencia de residuos
fibrosos perivasculares derivados de otros brotes inflamatorios agudos anteriores.
Exposición de la vesícula
biliar
Con frecuencia, la vesícula
se halla incluida dentro del plastrón
inflamatorio perivesicular, que se desprenderá con un electrocoagulador, con un tampón o mediante la cánula de aspiración, separando el colon transverso derecho y el duodeno
en las inmediaciones del infundíbulo. Las paredes
inflamatorias y gruesas
de la VB en la colecistitis aguda hacen difícil
asirla. Por consiguiente, se aconseja puncionarla con la aguja de Veress al principio
de la intervención quirúrgica y aspirar
la bilis alterada
o purulenta. Finalmente, las dificultades de exposición suelen obligar
a colocar otro trocar
adicional.
Disección del triángulo de
Calot
La disección del triángulo de Calot implica
especialmente un
riesgo en las formas
avanzadas de colecistitis aguda o de colecistitis escleroatrófica, en las que la VB es pequeña, se encuentra retraída sobre los cálculos,
tiene paredes gruesas y una fibrosis retráctil significativa en el triángulo
de Calot. Esta disección se efectuará
con tampón montado sobre pinza atraumática o con un electrocoagulador, minimizando el uso de la coagulación monopolar.
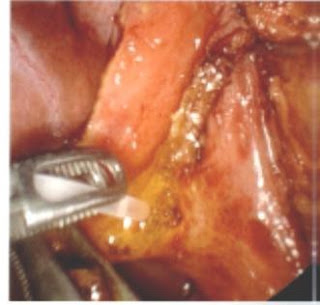
Visión quirúrgica de la disección del pedículo
hepático con tampón montado tipo peanuts sobre pinza atraumática
en el curso de una colecistectomía
laparoscópica para una
colecistitis aguda.
La hemorragia es difusa, nubla el campo quirúrgico y obliga a
irrigar y aspirar de manera
permanente. La disección
debe permanecer en contacto con la pared vesicular.
En determinados casos difíciles puede considerarse útil una vía anterógrada parcial que parte del fundus
vesicular en dirección
al triángulo de Calot, con la condición
de permanecer estrictamente en contacto
con el borde superior de la VB y de no seguir la
disección en la dirección del pedículo hepático desde el momento que se han desprendido el
fundus y el
cuerpo de la vesícula.
Representación esquemática de
una colecistectomía difícil
en estados inflamatorios graves: disección vesicular anterógrada parcial, limitada en el fondo y en el cuerpo de la vesícula,
detenida a nivel del infundíbulo vesicular y asociada
con una abertura del cuello vesicular
para desenclavar una macrolitiasis infundibular enclavada.
Si existe un macrocálculo enclavado en el infundíbulo vesicular que
impide el acceso al triángulo de Calot, puede ser necesario abrir el infundíbulo (prestando atención a la hemostasia de la pared vesicular si la arteria
cística no se ha controlado de antemano)
y desenclavar el macrocálculo con la pinza; éste se coloca entonces
en un saco de extracción situado en la cara superior de la parte derecha del hígado.
Visión quirúrgica de la abertura del cuello vesicular
para desenclavar una macrolitiasis infundibular enclavada.
Esta técnica de abertura del infundíbulo es igualmente útil si la disección en el triángulo
de Calot es peligrosa. Esta vía endovesicular permite controlar la
disección de la pared vesicular
desde el exterior
y el interior, lo que mejora el reconocimiento de los límites de la VB en el triángulo
de Calot, que presenta procesos inflamatorios significativos.
Tras la
abertura voluntaria del infundíbulo vesicular, visión quirúrgica del control de la
disección de la pared vesicular desde el exterior
y desde el
interior.
También es posible localizar el CC
desde el interior
y cateterizarlo para llevar a cabo la CPO.
En caso de inflamación aguda
o escleroatrófica significativa que impide la disección del triángulo de Calot, de compresión de la VBP por el infundíbulo vesicular o, por último,
en caso de convergencia
biliar escalonada, puede considerarse útil llevar a cabo una colecistectomía subtotal, dejando una parte del infundíbulo vesicular para proteger el árbol biliar extrahepático (conducto
hepático común o convergencia biliar escalonada)
Colangio-RM preoperatoria que pone de
manifiesto varios factores de riesgo en un paciente intervenido quirúrgicamente por una colecistitis aguda enfriada:
una macrolitiasis infundibular enclavada y un conducto cístico
corto que nace de una convergencia biliar escalonada.
Colecistectomía subtotal, dejando en
su sitio un patch de infundíbulo vesicular en los estados inflamatorios graves en que existe
peligro en la disección del infundíbulo vesicular (compresión biliar, síndrome de Mirizzi,
convergencia biliar escalonada, etc.). a. Representación esquemática. b. Visión
quirúrgica.
En este caso, tras una CPO de control para asegurar la integridad del árbol biliar y que no existe
ninguna litiasis en el colédoco asociada, se sutura selectivamente el CC por vía endovascular, se elimina
con argón o electrocoagulación la mucosa del patch infundibular y se coloca un drenaje subhepático en el hiato de Winslow.
Esta técnica resulta muy segura en las situaciones complejas. No obstante, conviene evitar que se diseminen
los cálculos intravesiculares, lo cual puede
ser
molesto en caso de
empedramiento múltiple. Asimismo, debe excluirse una neoplasia
vesicular subyacente. En determinadas colangitis necróticas el plano de disección del
lecho vascular es difícil
de localizar o es
inexistente. No es excepcional
tener que dejar un fragmento
de pared vesicular
en el lecho vesicular
para evitar dañar el parénquima hepático, lo que provoca
una hemorragia
abundante.
Colecistectomía subtotal: colangiografía peroperatoria
por
vía endovesicular.
Colecistectomía subtotal:
sutura del conducto cístico por vía endovesicular.
Colecistectomía subtotal: vaporización con argón de
la mucosa del patch infundibular que queda en su sitio.
Fístulas colecistoentéricas y biliobiliares
Las fístulas bilioentéricas son colecistoduodenales más que colecistocólicas. Deben considerarse, al margen de un caso particular de la
cirugía biliar laparoscópica, como contraindicaciones para
proseguir con la intervención laparoscópica. Si el trayecto fistuloso se puede individualizar de forma clara, la sección de la fístula en su vertiente
digestiva (no vesicular) puede hacerse
gracias a la aplicación de una (o dos) sutura-sección mecánica
lineal, que se completará
con
puntos sueltos
o una sutura interna. La continuación de la intervención biliar no presenta
particularidades, excepto
por la frecuencia de coledocolitiasis.
Las fístulas biliobiliares son cístico o infundibulohepáticas. Se observan en pacientes
con enfermedad biliar aguda o tras varios brotes infecciosos tratados con fármacos. La imposibilidad de disecar bien el triángulo
coledococístico suele conllevar
la conversión en laparotomía que se deberá realizar como norma
cuando se observan las
fístulas en el
laparoscopio.
Pancreatitis aguda
El tratamiento laparoscópico es posible en pacientes
cuya litiasis biliar se haya diagnosticado junto con una pancreatitis aguda. La puntuación de Ranson evalúa la gravedad de la pancreatitis aguda. En las benignas, es inútil retrasar
la cirugía por laparotomía más allá del intervalo necesario para el estudio
del pronóstico de la enfermedad. En las
formas graves, la cirugía de urgencias aumenta
la morbilidad y se debe dar prioridad al tratamiento de la pancreatitis y de sus complicaciones. Además, durante la laparoscopia, la gravedad
de la pancreatitis se asocia con mayores dificultades y a un mayor riesgo de conversión en laparotomía.
La tomografía computadorizada (TC) pancreática, realizada antes de la intervención biliar, valora el volumen de la glándula o de los seudo quistes necróticos, que pueden disminuir
el volumen disponible para
la intervención a la hora de crear el
neumoperitoneo.
Anatomía del
pedículo
Es necesario conocer
la anatomía biliar para interpretar la colangiografía peroperatoria. Las variaciones de la anatomía de los conductos biliares aparecen sobre todo en los del lado derecho:
subdivisión del conducto
hepático derecho en sus componentes segmentarios y desplazamiento hacia
abajo o hacia la
izquierda de un conducto sectorial. Las variaciones anatómicas se detectan mediante el cartograma intrahepático durante la colangiografía peroperatoria. Es indispensable saber reconocer y enumerar los diferentes conductos sectoriales para poder garantizar que no falte ninguno. Las variaciones «con riesgo» son aquellas que modifican
la anatomía del pedículo.
La confluencia de un conducto cístico corto puede realizarse con uno de los conductos
hepáticos derechos subdivididos.
Antecedentes de cirugía abdominal
Un antecedente de cirugía
abdominal justifica la creación
de un neumoperitoneo mediante la técnica «abierta» debido a que resulta imposible prever
con seguridad que no exista ninguna adherencia visceral a la pared abdominal. Sólo un cirujano
experimentado en laparoscopia puede considerarse autorizado
a realizar una colecistectomía laparoscópica en caso de que existan antecedentes de cirugía supra-mesocólica.
Después de crear el
neumoperitoneo, se deben elegir zonas libres de adherencias para introducir, poco a poco, los demás trocares necesarios para la intervención y crear mediante
disección un espacio
infrahepático útil para la colecistectomía.
Obesidad
La obesidad conlleva más dificultades operatorias en el hombre
que en la mujer. La creación del neumoperitoneo es delicada,
sea cual sea la técnica
elegida, debido al espesor de la
pared. El peso del panículo adiposo abdominal
justifica el aumento de la presión intraabdominal
a 15 mm Hg. La posición
proclive utiliza la gravedad
para hacer descender la cubierta
epiploica y mejora las condiciones de ventilación peroperatoria al disminuir la presión
de las vísceras sobre las cúpulas diafragmáticas. Frente a las dificultades reales de esta cirugía en el paciente
obeso, se deben valorar todos
los beneficios que pueden
obtenerse de una intervención que intenta
minimizar la morbilidad parietal, más
frecuente en estos pacientes.
Embarazo
Durante el embarazo pueden realizarse procedimientos de cirugía laparoscópica. De forma esquemática, una operación
quirúrgica durante el primer trimestre
del embarazo corre el peligro de desencadenar un aborto,
y durante el tercer trimestre, un parto prematuro. Por tanto,
el trimestre
«Óptimo» para esta operación, cuando es absolutamente necesaria, es el segundo. La indicación de colecistectomía en el embarazo se reserva a las pacientes
que tienen signos clínicos,
analíticos y ecográficos (microlitiasis) que indican una posible
migración de los cálculos al colédoco. Durante el segundo trimestre de embarazo también se puede realizar una colangiografía peroperatoria.
Desde el punto de vista técnico, se recomienda utilizar una técnica
abierta para crear el neumoperitoneo y evitar el ombligo para el primer
trocar. La localización de los trocares se desplaza más
hacia el hipocondrio derecho a
medida que avanza la edad gestacional. La presión intraabdominal está limitada a 10 mm
Hg, o incluso a 8 mm Hg.
Conversión a laparotomía en los casos difíciles
La transformación peroperatoria de una intervención por vía laparoscópica en laparotomía se produce en el 1-3% de las patologías litiásicas vesiculares no complicadas y en el 10-30%
de las formas
complicadas [15]. He aquí
las
principales indicaciones:
-
Todas las situaciones difíciles de disección quirúrgica (colecistitis aguda, colecistitis escleroatrófica, fístula
biliodigestiva, síndrome de Mirizzi.
etc.) cuando la experiencia del cirujano es limitada.
-
Todos los procesos inflamatorios locales en los que la disección
se considera peligrosa en la región del pedículo
hepático, en particular si no hay un reconocimiento anatómico claro tras una duración
significativa de la disección.
-
En caso de complicación peroperatoria:
hemorragia, fuga biliar de origen desconocido en ausencia de perforación vesicular,
lesión biliar claramente documentada, lesión vascular o visceral.
imposibilidad de recuperar
totalmente cálculos diseminados dentro de la cavidad
peritoneal.
-
En caso de duda en
cuanto a la integridad del árbol biliar en la
epo (ausencia
de opacación de las vías biliares
altas, árbol biliar hepático
derecho incompleto, extravasación del agente
de contraste).
La conversión es una prueba
de seguridad quirúrgica y debe ser percibida como tal por el cirujano. Siempre es mejor una conversión «con éxito» que una colecistectomía laparoscópica con complicaciones biliares,
digestivas y hemorrágicas graves.
¿Cuándo debe efectuarse la conversión en laparotomía?
•Disección difícil
(colecistitis, etc.) cirujano poco experimentado.
•Ausencia de reconocimiento anatómico claro.
•Complicación peroperatoria:
hemorragia, fuga biliar complicada, lesión vascular
o visceral, etc.
•Duda en cuanto a la integridad del árbol biliar (epO).
Complicaciones postoperatorias
Traumatismo quirúrgico de la VBP
Se trata del accidente peroperatorio más grave de la colecistectomía laparoscópica, a menudo con complicaciones graves para
el paciente y problemas
médico-legales para el cirujano.
Hemorragia
Las complicaciones
hemorrágicas pueden producirse en varias circunstancias. Hemorragia difusa
en caso de colecistitis aguda
En general, fuera de las alteraciones de
la coagulación, la 22 «barohemostasia» asociada con el
neumoperitoneo es suficiente para controlar las hemorragias difusas en sábana. No
obstante, la presencia de sangre nubla
la imagen; por una parte, es
preciso disponer de una cámara endoscópica
y, por la otra, irrigar
con frecuencia el campo quirúrgico con suero fisiológico. Es preciso evitar emplear electrocoagulación en exceso.
¿Qué hacer en caso de hemorragia
aguda?
•Pinzamiento en bloque o compresión del foco hemorrágico.
•Trocar y elementos auxiliares adicionales.
•Lavado-aspiración.
•Disección e identificación de la estructura
vascular lesionada.
•Hemostasia por un clip electivo o con la pinza bipolar.
•Conversión y reparación con hilo fino si está lesionada
la arteria hepática o su rama derecha.
Hemorragia aguda
La hemorragia puede producirse a partir de la arteria cística,
de la rama derecha de la arteria hepática o más raramente
de la vena porta.
Con frecuencia, el sangrado es espectacular y, por una parte, conviene no ser presa de pánico y, por otra, hacer retroceder la óptica a distancia
del jet (chorro)
arterial para evitar mancharse y, perder así, la visión del campo operatorio, especialmente útil en esta situación de emergencia.
El gesto de hemostasia
comprende las etapas siguientes:
-
En primer lugar, un
gesto de hemostasia transitoria que contempla pinzar en bloque
la arteria lesionada con una pinza fenestrada atraumática o comprimirla por medio de la cánula de aspiración. En ningún caso se emplearán
la electrocoagulación o la colocación de un clip a
ciegas.
-
Si es preciso
(p. ej., en un paciente
obeso) debe añadirse de nuevo un trocar suplementario y/o llamar a un cirujano
experimentado.
-
No debe aspirarse de manera permanente, lo cual suprime el neumoperitoneo y, por consiguiente, la visión del campo operatorio.
-
Lavar el foco hemorrágico y aspirar por contado.
-
Disección de la estructura
arterial en cuestión.
-
Realizar la hemostasia definitiva por medio de un clip colocado
electivamente o aplicando
la pinza bipolar
sobre el foco de hemorragia.
-
En caso de lesión de la rama derecha
de la arteria hepática, especialmente expuesta en caso de una arteria
cística corta, no debe pinzarse el vaso, sino efectuar
una conversión a laparotomía a fin de reparar escrupulosamente la arteria con hilo monofilamento 5 o 6/0.
Durante el tiempo de conversión requerido se detiene la hemorragia mediante una pinza fenestrada atraumática situada lo más próxima
posible sobre el foco hemorrágico.
Lesión hepática
durante la disección del lecho vascular
Se produce cuando hay un error en el plano de despegamiento ente el hígado y la
VB, lo cual sucede en determinadas colecistitis. El plano de disección
es a veces difícil de encontrar, o es inexistente, y si se desea resecar por completo la VB se sitúa inevitablemente en el seno del parénquima hepático, de ahí el riesgo de hemorragia y/o de fístula
biliar.
En caso de sangrado demasiado abundante es preferible mantener una parte de la pared vesicular
en contacto con el hígado. En general, la hemorragia se controla fácilmente a través de uno de los medios siguientes: eledrocoagulación mono o bipolar,
vaporización con argón, colocación de compresas
hemostásicas reabsorbibles, compresión simple con un instrumento atraumático o mediante
una gasa o puntos
de sutura
en
X.
Hemorragia en el orificio de trocar
Por regla general todos los trocares deben retirarse uno a uno bajo control endoscópico. El hecho de no detectar una hemorragia arterial en el orificio de trocar
expone a un riesgo de hemoperitoneo postoperatorio. Un sangrado moderado
puede controlarse fácilmente a través de diferentes medios: compresión interna con la ayuda del trocar propiamente dicho o de un instrumento, eledrocoagulación desde el interior,
una sonda de Foley introducida a través del orificio del trocar, retirada de un balón hinchado,
y manteniendo la tracción
con una pinza de
Kocher colocada a ras de piel durante 5 mino En caso de hemorragia significativa o, en caso de sangrado arterial (arteria epigástrica), será preciso recurrir a puntos totales
transparietales o a agrandar la incisión y llevar a
cabo una hemostasia electiva (puntos
en X).
Lesión digestiva
Las lesiones
digestivas (gástrica, duodenal, cólica, etc.) en el curso de una colecistectomía laparoscópica son muy infrecuentes pero pueden producirse ya sea en la introducción a ciegas de la aguja de Veress
o del primer trocar, o en el momento
de resecar adherencias inflamatorias perivesiculares.
Más que su prevención mediante una técnica adecuada (p. ej., sonda gástrica
previa a la introducción de la aguja de Veress para prevenir una lesión
gástrica), es sobre todo la necesidad
absoluta de su detección
peroperatoria lo que importa con el fin de evitar una peritonitis
postoperatoria no detectada. Hay que controlar las lesiones viscerales perforantes con
una brecha posterior que puede pasar desapercibida. La reparación mediante sutura puede efectuarse por vía laparoscópica si la exploración de la lesión es completa
y la experiencia quirúrgica en suturas intraperitoneales
es adecuada.
Abertura accidental
de la VB y diseminación Iitiásica intraperitoneal
Esta complicación, que se produce a menudo durante la disección de una colecistitis difícil no es tan banal como podría pensarse,
ya que puede ser responsable de un absceso postoperatorio tardío y recidivante sobre una litiasis
intraperitoneal residual. En
este contexto clínico, una radiografía de abdomen
sin preparación o un examen tomodensitométrico sin inyección del abdomen pueden poner de manifiesto cálculos residuales,
que a veces van a
justificar una re intervención quirúrgica.
En la práctica, desde el momento
que tiene lugar una perforación vesicular se aconseja extraer los cálculos
uno a uno con la pinza o
colocarlos en un saco de extracción, dispuesto en posición
de espera en la cara superoexterna del hígado derecho.
A veces, es posible volver a cerrar la perforación (sutura, endoloop, etc.). En caso de perforación vesicular deberá retirarse de la cavidad peritoneal
la totalidad de los cálculos perdidos y extraerlos con la VB dentro de un saco de protección.
Lesiones biliares
La complicación más frecuente que se observa
durante la colecistectomía laparoscópica es la rotura de la pared de la vesícula. La salida de bilis, incluso infectada, puede controlarse rápidamente mediante lavado-aspiración. Se aconseja entonces vaciar completamente el contenido
biliar de la vesícula
ya que es necesario
recuperar todos
los cálculos. Se han descrito varias complicaciones relacionadas con los cálculos
abandonados en el abdomen o encontrados de forma secundaria en el trayecto
de un trocar. El lavado y la aspiración son útiles
para recuperar pequeños cálculos que se pegan a la cánula y pueden entorpecer el funcionamiento. Hay que buscar
posibles cálculos bajo el hígado, en la punta del lóbulo derecho, en el espacio interhepatodiafragmático y por detrás
del pedículo.
La complicación biliar más grave durante la colecistectomía laparoscópica es la lesión del conducto
biliar. Este riesgo se ha multiplicado por tres en la técnica
laparoscópica frente a la laparotomía: 0,6 frente a 0,2 %, respectivamente. Las estadísticas más recientes siguen hablando
de lesión biliar en el 0,6 al 0,8 % de los casos. Este riesgo es más significativo durante las
primeras 20 colecistectomías: se han descrito cifras que alcanzan
el 2 %. No existe relación
demostrada entre el riesgo de lesión biliar y las variaciones anatómicas del pedículo
biliar. La mayoría de las lesiones biliares aparece durante colecistectomías
que no presentan especial dificultad. Un estudio
poblacional detectó una disminución del riesgo de lesión biliar durante
la colecistectomía cuando ésta
se
acompañaba de una colangiografía peroperatoria. En todos
los casos en los que la colangiografía detecte una lesión biliar, sólo debe continuar
la laparoscopia un cirujano
experimentado. Cualquier
otro cirujano deberá
convertir la cirugía en laparotomía y obtener mediante estudio radiológico y quirúrgico una valoración precisa de la complicación. En función de la habilidad del cirujano o del nivel técnico del centro,
se decidirá entre una reparación inmediata
o la
derivación del paciente a
un servicio especializado.
Complicaciones postoperatorias
El postoperatorio de una colecistectomía laparoscópica tiene que ser «simple». Cualquier signo anormal
en las primeras
24 horas debe tenerse
en cuenta: dolor, fiebre,
íleo o imposibilidad para
alimentarse.
Complicaciones biliares
La fuga de bilis es la complicación más temida. En alrededor del 15 % de los casos, se trata de un goteo biliar por el drenaje colocado al final de la intervención. En el resto de los casos, se trata de un derrame
biliar generalizado intraperitoneal (coleperitoneo) o un «bilioma» infrahepático. La sensibilidad de los signos y síntomas
del coleperitoneo postoperatorio es mala. En uno de cada dos casos se presentan
dolor, sensación de malestar
general, ictericia o un aumento de la bilirrubina. En tres o cuatro casos de cada diez se observa fiebre, meteorismo y náuseas o vómitos. Menos de un paciente de cada cinco presenta
signos peritoneales. El hecho de que la fístula biliar se drene, disminuye la frecuencia del dolor, de la fiebre y del íleo reflejo, pero no reduce la frecuencia de ictericia
y de signos peritoneales. En uno de cada
cuatro casos, se observa un
cuadro clínico que recuerda a una colangitis, se haya
realizado drenaje o no. El diagnóstico de la acumulación intraperitoneal se realiza inicialmente mediante ecografía
y se completa
con
una tomografía computadorizada abdominal. El
diagnóstico de la fuga de bilis se confirma al observar la imagen en la colangiografía retrógrada, sobre todo, o en la colangiografía directa si se había
colocado un drenaje biliar externo. La fistulografía del tubo de drenaje
es inútil en el postoperatorio precoz. Las fístulas
biliares que se originan
en un conducto accesorio en el lecho vesicular pueden secarse de forma espontánea o justificar una nueva exploración mediante laparoscopia o laparotomía. Las fístulas biliares por relajación del muñón cístico se diagnostican mediante la introducción retrógrada
endoscópica de contraste y se tratan mediante
endoprótesis con o sin esfinterotomía. Las fístulas
biliares por lesiones
del colédoco tienen un tratamiento más complejo y no forman parte de este capítulo. Si no se trata de un centro especializado, deben ser drenadas y derivadas
sin retraso para llevarlo
a cabo.
Complicaciones hemorrágicas
La complicación hemorrágica más grave, y que puede ser rápidamente mortal, es la lesión de los vasos retroperitoneales durante la creación
del neumoperitoneo, que puede pasar desapercibida durante la intervención. El diagnóstico se sospecha cuando aparece un shock en la sala de despertar. Se debe volver inmediatamente al quirófano y realizar
una laparotomía de urgencia para
evitar lo peor.
La hemorragia en uno de los orificios de los trocares es mucho menos alarmante, aunque pueda acabar de forma secundaria en una transfusión o incluso
en una reintervención. El diagnóstico viene dado por la pérdida sanguínea postoperatoria cuya causa sólo se averigua cuando se vuelve a intervenir. La laparoscopia no es el método más «adecuado» para volver a explorar
un hemoperitoneo. Es difícil
realizar el lavado y la aspiración de los coágulos
mediante laparoscopia y esta nueva exploración debe terminar con la certeza de haber identificado con precisión el
origen de la hemorragia. Por tanto, se recomienda realizar una laparotomía
si
la primera reexploración laparoscópica
no alcanza el objetivo
previsto.
Cuidados postoperatorios
Habitualmente, las repercusiones
postoperatorias de una colecistectomía
laparoscópica son muy simples, incluso en caso de colecistitis aguda. La reanudación del tránsito intestinal y la rehabilitación funcional del paciente son rápidas, hasta el punto de que la gran mayoría
de los pacientes abandonan el hospital
entre el primero
y el tercer día después de la intervención quirúrgica. Se considera que la persistencia de los dolores abdominales más allá de dos o tres días después de la cirugía, así como la presencia de bilis o
de sangre en el
drenaje infrahepático debe hacer pensar en la posibilidad de una complicación. Ello debe llevar a realizar
un control biológico
y una prueba de imagen, la mayoría
de veces una ecografía. Se considera anodino observar una discreta
alteración postoperatoria transitoria de la biología
hepática, pero la aparición de una colestasis debe hacer pensar
en una complicación biliar. Del mismo modo, en la ecografía es habitual
la presencia de una colección
a nivel del lecho vesicular, aunque el aumento de dicha colección
o la presencia de una ascitis difusa deben hacer pensar de nuevo en una complicación biliar.
Bibliografía
& Ashcraft. Cirugia
pediátrica. Mc Graw hill.
&
Barkun, 1993.
Randomised controlled trial of laparoscopic versus mini cholecystectomy. Barkun js, barkun an, sampalls js et al.
Lancet 1993, 341: 1214-1215.
&
Bingener, 2002. Reasons for conversion from laparoscopic to open cholecystectomy: a 10-year review. Bingener-casey j, richards ml, strodel we et al. J gastrointest surg 2002,
6:
800-805.
& Bismuth,
1981. Les traumatismes opératoires de la voie biliaire
principa/e. Monographies de l'association fran~ aise de chirurgie. Bismuth h, lazorthes
f. Masson, paris, 1981, vol 1.
&
Blumgart Cirugía de hígado, páncreas, y vía
biliar. 5th Edición. Editorial Saunders
&
Bockus. Gastroenterología. Salvat.
&
Brunicardi. Schwartz, Principios de cirugía.
9na. Edición. Mc Graw Hill.
& Carico. Atlas
tratamiento quirúrgico del trauma. Mc Graw Hill.
&
Champault, 1996.
Serious trocar accidents in laparoscopic surgery: a french
survey of 103852 operations.Champault
g, cazacu f, taffinder
n. Surg laparosc endosc 1996, 6: 367-370.
&
CMCG. Tratado de cirugía general. 2da.
edición. Manual moderno
& Cunningham. Williams obstetricia.
Panamericana.
& Díaz rubio. Trastornos
motores del aparato digestivo. Panamericana.
&
Drossman. The functional Gastrointestinal
Disorders, Rome III.
&
Elsevier
2014. Tratado de Cirugía del aparato digestivo.
&
Elsevier 2014. Tratado de Cirugía plástica.
&
Elsevier 2014. Tratado de Cirugía General.
&
Elsevier 2014. Tratado de Ginecología y
obstetricia.
&
Elsevier 2014. Tratado de Medicina.
&
Elsevier 2014. Tratado de Pediatría.
&
Elsevier tratado de Urología, 2014.
&
Flum, 2003. Intraoperative cholangiography and risks of common bile duct injury during cholecystectomy. Flum d, delllnger
e, cheadle a et al. Jama 2003, 289: 1639-1644.
& Garber,
1997. Early laparoscopic cholecystectomy for acute cholecystitis. Garber sm, korman j, cosgrove jm, cohen jr. Surg endosc 1997,
11: 347-350.
&
Gigot, 1997. The dramatic reality of biliary tract injury during laparoscopic cholecystectomy: an anonymous multicentric belgian survey of 65 patients.
Gigot jf, etienne j, aerts r et al. Surg endosc 1997,11: 1171-1178.
&
Gleicher. Tratamiento de las complicaciones
clínicas del embarazo. Panamericana
&
Gliedman. Atlas de técnicas quirúrgicas. Mc
Graw Hill.
& Goldberg. Fundamentos de
cirugía anorectal. Noriega Limosa.
&
Gutiérrez Samperio. Fisiopatología quirúrgica
del aparato digestivo. 2da. edición. Manual Moderno.
&
Hinman. Atlas de cirugía urológica. Mc Graw Hill.
& Kiviluoto,
1998. Randomised trial of laparoscopic versus open cholecystectomy for acute and gangrenous cholecystitis.Kiviluoto t, siren j, luukkonen p, kivilaakso e. Lancet 1998, 351:
321-325.
&
Madden. Atlas
de técnicas en cirugía.
&
Madrazo, Nutrición y gastroenterología
pediátrica. Mc Graw Hill.
&
Maingot-Zinner. Operaciones abdominales. 11
va. edición Panamericana.
& Majeed,
1996. Randomised, prospective,
single-blind comparison of laparoscopic versus smallincision cholecystectomy.
Majeed aw, troy g, nicholl
jp et al. Lancet 1996, 347: 989-994.
&
Mattox. Trauma. Mc Graw hill.
&
Mayagoitia. Hernias de la pared
abdominal. 2da. edición. Mc Graw Hill.
& Mcmahon,
1994. Laparoscopic versus minilaparotomy cholecystectomy: a randomised trial. Mcmahon aj, russel it, baxter jn et al. Lancet 1994,
343: 135-138.
&
Michael Henry. Cirugia clínica. Masson.
&
Misiewicz. Atlas de gastroenterología
clinica. Mossby.
& Mouiel,
1991. La cholécystectomie par laser en c~liochirurgie. Testas p., delaitre
b. Chirurgie digestive par
voie ca2lioscopique. Mouiel j, katkhouda
n. Maloine, paris, 1991 : 113-119.
& Navez,
2001. Safety of laparoscopic approach for acute cholecystitis: retrospective study of 609 cases.Navez b, mutter d, russier yet al. Worldj surg 2001,25:
1352-1356.
&
Neudecker, 2002. The e.a.e.s. clinical
guidelines on the pneumoperitoneum for laparoscopic surgery. Neudecker
j, sauerland
s, neugebauer
eet al.
Surg endosc 2002, 16:
1121-1143.
& Neugebauer,
2000. Recommendations for evidence-based
endoscopic surgery. The updated
eaes consensus deve/opment conferences. Neugebauer
e, sauerland
s, troidl
h.
Springer-verlag, 2000.
&
Nyhus. Dolor abdominal. Editorial paramericana
&
O´Neil. Pediatric surgery. Mosby.
& Perera. Cirugía de urgencia. 2da. edición. Interamericana.
&
Pérez de Gallo, Dietas. Ediciones científicas
la prensa medica mexicana.
&
Quintero. Infeccion en cirugía. Editoral
panamericana
&
Robles. Nutrición en el paciente críticamente
enfermo. Mc Graw Hill.
&
Rock. Te Linde. Ginecologia quirúrgica.
Panamericana
&
Sabiston. Atlas de cirugía. Mc Graw Hill.
& Sabiston. Tratado de
cirugía. Mac Graw Hill
&
Skandalakis. Hernias. Mc Graw Hill.
&
Skandalakys. Complicaciones anatómicas en
cirugía general. Mc Graw Hill.
&
Stoopen. Radiologia e imagen diagnóstica y
terapéutica. Abdomen Tomo I. Editorial
Lippincott.
&
Suros. Semiologia médica y técnica
exploratoria. Masson.
& Testut-Latarget.
Anatomía Humana. Salvat.
&
Valenzuela. Gastroenterología y hepatología.
Mediterráneo
&
Villazón- arenas. Nutrición enteral y
parenteral. Interamericana
&
Way. Diagnóstico y tratamiento
quirúrgicos. Manual moderno.
&
Wolfe. Terapeutica de los trastornos
digestivos. Mc Graw Hill.
& Yoshida,
1996. Practical c1assification of the branching types of the biliary
tree: an analysis
of
1,094 consecutive direet cholangiograms Yoshida
j, chijilwa k, yamaguchi k et al.. J am col/ surg 1996,
182:
37-40.
&
Zuidema-Shackelford. Cirugía del aparato
digestivo. 6ta edición. Interamericana.








No hay comentarios.:
Publicar un comentario