APENDICECTOMÍA
LAPAROSCÓPICA
Dr. Juan
Hernández Orduña.
Semm practicó la primera
apendicectomía laparoscópica en 1982. Desde entonces, la comparación con la
laparotomía no ha perdido actualidad, como lo demuestra la abundante
literatura.
Se sabe que la laparoscopia
reduce el dolor, la morbilidad parietal, el perjuicio estético y el tiempo de
hospitalización, además de abreviar el período de ausencia laboral. Por el
contrario, se trata de una intervención más larga y más cara que la
laparotomía, aunque a la hora de analizar costes globales debe estimarse el ahorro
obtenido por reducción del tiempo de inactividad. Las complicaciones más
frecuentes pueden evitarse si el cirujano sigue un aprendizaje riguroso. Se
describirán las dos técnicas vigentes en la actualidad: la apendicectomía
totalmente intrabdominal, llamada «in», y la extrabdominal, llamada «out», con
su variante por monoacceso transumbilical (Begin).
Indicaciones
En general, la intervención
abdominal más común sigue siendo la apendicectomía, pese a que su frecuencia ha
disminuido desde hace dos décadas (Msika,1999).
A fin de reducir la cantidad
de apendicectomías innecesarias, se han establecido unas escalas clínicas,
biológicas y radiológicas, para predecir la apendicitis aguda. En ocasiones, la
laparoscopia hace que se rectifique el diagnóstico inicial, pues mediante la
exploración abdominal completa se puede descubrir un cuadro distinto y/o
comprobar que el apéndice se encuentra sano [Polliand, 2004. Champault, 1997].
Esto atañe, de manera más directa, a las mujeres en período de actividad
genital [Sauderland, 2004]. Se ha calculado un 5% de conversiones a la
laparotomía [Liu, 2002]. Los siguientes factores tienen valor para predecir la
conversión: existencia de una masa o de un absceso en las exploraciones
preoperatorias, edad superior a 65 años [Guller, 2004] y experiencia del
cirujano [Noble, 2003]. La principal causa de conversión es el plastrón
apendicular.
Para la
apendicectomía valen las
contraindicaciones de cualquier
laparoscopia: los antecedentes múltiples de cirugía abdominal
(contraindicación relativa) y la deficiencia visceral que impide la creación de
un neumoperitoneo.
En el niño, el acceso
laparoscópico se rige por los mismos principios técnicos que en el adulto, y
arroja los mismos resultados (El Ghoneimi, 1994. Lee, 2003. Ikeda, 2004.
Steyaert, 1999)
Principios técnicos
Consentimiento informado
El consentimiento del paciente
se obtiene después de haberle brindado información clara y precisa sobre el
supuesto diagnóstico, las diversas técnicas, con sus ventajas e inconvenientes,
y las posibles complicaciones, incluidas las más excepcionales. Tras la
operación, se le explica en qué ha consistido, y se le entrega un documento
escrito donde se confirma la exéresis del apéndice pese a la ausencia de
incisión en la fosa ilíaca derecha.
Preparación y
anestesia
En la consulta preanestésica,
además de efectuar las exploraciones de rutina, se averigua si existen factores
que puedan contraindicar la creación del neumoperitoneo. La preparación local
comprende el rasurado abdominal, la desinfección umbilical y la evacuación de
la vejiga por micción. Si el diagnóstico plantea dudas en una mujer, puede
justificarse la colocación de una sonda. Se prescribe una profilaxis
antibiótica de manera sistemática.
Colocación del
paciente
El paciente se coloca en
decúbito dorsal, con ambos brazos a lo largo del cuerpo y los miembros
inferiores sobre apoyos para que, si es necesario, el cirujano pueda colocarse
entre las piernas. La mesa tiene que poder adoptar las posiciones de
Trendelemburg, proclive y lateral izquierda o derecha. El amplio campo
quirúrgico expone la totalidad del abdomen, de modo que se puedan colocar
trocares complementarios. El cirujano se sitúa a la izquierda del paciente, el
asistente frente a él, y el instrumentista a su izquierda (Figura 1A).
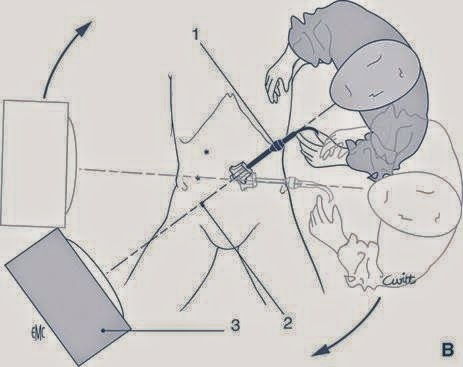
Como en todo procedimiento
laparoscópico, el eje visual del cirujano, la zona que se va a intervenir y la
pantalla deben encontrarse sobre una misma línea (Figura 1B). La pantalla se
desplaza según la situación del apéndice: hacia la parte inferior derecha del
paciente, si es normotópico, y hacia la parte superior derecha, si está en
posición alta infrahepática.
Figura 1. A. Posición del paciente y del equipo
quirúrgico (A: Ayudante, C: cirujano, I: instrumentista)
B. Eje cirujano-zona
quirúrgica-monitor. 1. Sistema óptico; 2. Eje de visión; 3. Monitor.
Material
El instrumental es el mismo
para todas la técnicas (Figura 2 A-C), a excepción de la vía transumbilical,
que tiene el suyo propio (Figura 2B). Comprende:
• un sistema de vídeo completo (Figura 2A);
• una óptica de visión recta o fore-oblique de 30° o 45°;
• un bisturí eléctrico, que posibilita la coagulación mono o
bipolar;
• un sistema de irrigación y lavado de alto flujo;
• una aguja tipo Veress;
• dos pequeños separadores tipo Chigot de 5 mm;
• un trocar óptico T1 de 10 mm;
• un trocar operatorio T2 de 5 o 10 mm y, si fuese
necesario, uno de 12 mm;
• un segundo trocar operatorio T3 de 5 mm;
• una pinza coagulante bipolar de 5 mm;
• tijeras de 5 mm, que posibilitan la coagulación mono o
bipolar;
• un juego de pinzas fenestradas atraumáticas de 5 mm;
• un palpador de 5 mm;
• un empujanudos;
• uno o dos portaagujas;
• una cánula de aspiración-lavado de 5 o 10 mm;
• una bolsa para extraer los tejidos.
Para practicar la técnica
extraabdominal transumbilical, se necesita una óptica específica con conducto
operatorio. Las pinzas, el coagulador, el aspirador y las tijeras deben ser lo
suficientemente largos.
Los instrumentos auxiliares
para cerrar los orificios de trocares son idénticos en todas las técnicas.
Figura 2 :
A. Circuito vídeo con óptica a 30 o 45°. 1. Cámara; 2.
insuflador; 3. procesador de vídeo; 4. fuente de luz fría; 5. sistema de
fotografía; 6. monitor.
B. Material para apendicectomía transumbilical asistida por
vídeo: 1. Óptica separada con conducto operatorio; 2. trocar de 10 mm; 3.
mandril romo; 4. trocar y mandril de 5 mm; 5. palpador; 6. pinza fina; 7.
gancho coagulador; 8. tijeras. 9. aspirador.
C. Material para apendicectomía laparoscópica; 1. Óptica de
30°; trocar de 10 mm; 3. trocar y mandril romo de 5 mm; 4. pinza bipolar
coagulante de 5 mm; 5. pinza atraumática de 5 mm; 6. tijeras de 5 mm; 7.
empujanudos; 8 nudo
prefabricado; 9. portaagujas;
10. palpador romo;
11. Bolsa de recuperación para tejidos blandos.
Técnica de
apendicectomía totalmente intraabdominal («in») Creación del
neumoperitoneo y colocación del trocar óptico T1
Para contar con un campo
visual lo más amplio posible, lo ideal es instalar el primer trocar T1 (Figura 3)
en el tercio superior de la cavidad abdominal [Sartori, 2004]. Se suele escoger
el ombligo por razones estéticas.
Figura 3: Introducción de la
óptica bajo control visual.
A. Incisión umbilical inferior. 1. Tejido subcutáneo; 2.
aponeurosis.
B. Anatomía del anillo umbilical.
C. Colocación del trocar romo.
Creación del
neumoperitoneo con la aguja de Veress
Si no hay antecedentes de
cirugía abdominal, se introduce la aguja de Veress en la parte superior del
ombligo. De lo contrario, se escoge el hipocondrio izquierdo. Para comprobar
que la aguja está bien colocada, se realiza una prueba de permeabilidad al aire
y otra de instilación-aspiración con 10 ml de suero fisiológico. El
neumoperitoneo se crea insuflando CO2 a razón de 4 l min-1 hasta alcanzar una
presión de 10 mmHg.
Se introduce un trocar T1 de
10 mm por una incisión vertical inferior en los pliegues radiales del ombligo,
describiendo una trayectoria en forma de bayoneta dirigida hacia la cavidad
pélvica. En los niños se puede utilizar un trocar de 5-7 mm. Mediante la
exploración endoscópica inicial, se comprueba la correcta posición del trocar y
que la retirada de la aguja no ha causado ninguna lesión [Montupet, 1993, El
Ghoneimi, 1994. Lee, 2003. Ikeda, 2004. Steyaert, 1999).
Creación del
neumoperitoneo con control visual («open»)
Como se corre el riesgo de
lesionar vasos o vísceras [Van der Voort, 2004], conviene proceder con control
visual [Begin, 1993. Lal, 2004. Khan, 2003]. Se empieza realizando una incisión
cutánea vertical de menos de 10 mm en los pliegues radiales del ombligo. Luego,
utilizando una pinza de disección con garra, se coge y se levanta la inserción
umbilical, y en su base se practica una incisión transversal de 8 mm.
Allí existe un solo plano
aponeurótico adherido al peritoneo. Después de haber comprobado, mediante unos
separadores, que no existen adherencias, se introduce un trocar atraumático
(romo o retráctil) de 10 mm, que se dirige hacia la cavidad pélvica. Gracias a
lo estrecho de la incisión aponeurótica, se evita cualquier pérdida de gas. Se insufla alrededor de 1 l de
CO2 a razón de 1 l/min. Con el
endoscopio, se comprueba que el trocar está bien colocado, y que durante esta
etapa de la operación no se han causado lesiones. Así pues, no se ejecuta
ninguna maniobra a ciegas. La presión intraabdominal debe ser lo más baja
posible, pero compatible con las necesidades de la intervención. Salvo en los
casos de obesidad, basta con 7 mmHg.
Exploración
abdominal y colocación del trocar T2
Para practicar la exploración
endoscópica de la cavidad abdominal, puede ser necesario modificar la posición
de la mesa de operaciones. Se examina el aspecto macroscópico del apéndice, del
peritoneo, del intestino delgado terminal, del marco cólico, del aparato
genital femenino y del fondo de saco de Douglas. Si el apéndice es normotópico,
resultará fácil de identificar. Para mejorar la exploración, se introduce con
control visual un segundo trocar T2 de 5 mm, para lo que, por razones
estéticas, se prefiere la región suprapúbica izquierda. Esta vía sirve para
introducir un palpador, útil a la hora de encontrar los apéndices ectópicos o
patológicos. Si existe un derrame intraperitoneal, debe tomarse una muestra
para examen bacteriológico.
Apendicectomía
laparoscópica
El dispositivo se completa con
un tercer trocar T3 de 5 mm, que se introduce en la región subumbilical
derecha. El cirujano expone y toma el apéndice manejando con su mano izquierda
los instrumentos que pasan por el trocar T2.
El T3 es el trocar operatorio
cercano a la mano derecha, pero su posición depende de la localización del
apéndice. Como en cualquier procedimiento laparoscópico, deben respetarse los
principios ergonómicos, evaluando la angulación entre T2 y T3 y evitando la
excesiva proximidad respecto al campo quirúrgico. Una posición demasiado
lateral en las fosas ilíacas o en los flancos resultaría perjudicial. Siempre
hay que conservar el eje cirujano-campo quirúrgico-monitor. El estado
patológico del apéndice puede justificar la instalación de un trocar de 10 mm
en T3.
Figura 4 : Según la
localización del apéndice Apéndice laterocecal interno o pélvico. A, B.
Posición de los trocares y de la instrumentación para la apendicectomía
laterocecal interna o pélvica. 1. Trocar óptico; 2. Instrumental en la mano
izquierda; 3. instrumental en la mano derecha.
Introduciendo una pinza
fenestrada por T2, se coge la extremidad del apéndice y éste se pone en
tensión. En T3, con una pinza o unas tijeras hemostáticas bipolares, se coagula
el meso, y luego se secciona, ya sea directamente, a nivel de su base,
permaneciendo a no menos de 10 mm de ésta, o bien a lo largo del apéndice
(Figura 5).
Figura 5 : Tracción del
apéndice y electrocoagulación del meso con pinza bipolar
Una vez expuesta la base
apendicular, se puede ligar el apéndice, bien mediante un nudo intracorporal,
utilizando uno o dos portaagujas, o, lo que resulta preferible, mediante un
nudo extracorporal, con ayuda de un empujanudos (Figura 6). Se aconseja
realizar una segunda ligadura 10 mm por encima de la anterior, con el objetivo
principal de evitar la evacuación de un estercolito hacia la cavidad abdominal
[Sauerland, 2004].
Figura 6 : Aplicación de la
ligadura en la base apendicular con ayuda de un empujanudos.
Con unas tijeras introducidas
por T3, se secciona el apéndice entre ambas ligaduras (Figura 7).
Figura 7: Sección del apéndice
entre dos ligaduras.
Hay que evitar la sección por
coagulación mono o bipolar, que podría destruir la sutura. Cuando existen
fenómenos infecciosos en el fondo cecal, y una simple ligadura parece
insuficiente o peligrosa, resulta preferible resecar dicho fondo. En este caso,
el trocar T3 de 5 mm se sustituye por otro de 12 mm, y se introduce un aparato
de sutura lineal de 30 mm [Daniell, 1991. Moser, 1992]. Para evitar el riesgo
de oclusión intestinal, hay que eliminar todas las grapas residuales
[Nottingham, 2002]. El apéndice se coloca en una bolsa de extracción
introducida por el trocar T1. El control visual se realiza desplazando la
óptica hacia un trocar de 10 mm, que puede haberse instalado en T3. De lo
contrario, la vaina del extractor se suprime después de haber soltado la bolsa,
seccionado el hilo y restituido la óptica a su sitio. Se controla la zona
intervenida, y si fuera necesario se procedería a irrigarla, para más tarde
retirar los trocares bajo control visual. Se deben cerrar todos los orificios
de más de 5 mm mediante una sutura aponeurótica de hilo absorbible en la medida
de lo posible con puntos invaginantes, ayudándose con los separadores de Chigot
(Figura 8). Para facilitar el drenaje, conviene evitar las suturas en el plano
cutáneo.
Figura 8: Cierre flojo del plano subcutáneo con puntos
invaginantes de hilo reabsorbible.
APÉNDICE
RETROCECAL.
Valiéndose del palpador
introducido por T2, e inclinando al paciente hacia la izquierda, siempre se
logra visualizar el apéndice retrocecal en toda su longitud. Cuando el apéndice
está en posición subserosa, puede revelarse necesaria la sección del peritoneo.
En casos excepcionales, se puede practicar la apendicectomía por vía
retrógrada. La base apendicular se tensa con una pinza fenestrada en T2. Las
tijeras sirven para crear una brecha en la zona avascular del meso (Figura 9A).
Más tarde, esta brecha se amplía por coagulación bipolar, y el apéndice se
secciona entre dos ligaduras (Figura 9B). Con las tijeras o con la pinza
coagulante bipolar en T3, el meso se secciona de manera progresiva hasta la
extremidad del apéndice (Figura 9C).
Figura 9: Técnica de la
apendicectomía retrógrada.
A. Abertura del meso.
B. Sección del apéndice.
C. Sección del meso hasta la punta.
D. Extracción del apéndice a través del trocar.
APÉNDICE SOBRE
EL CIEGO EN POSICIÓN INFRAHEPÁTICA.
Resulta esencial que la mesa
de operaciones se encuentre en posición proclive e inclinación lateral
izquierda. Si fuese necesario, se modificaría la posición de los trocares T2 y
T3, aproximándolos a la zona que se va a intervenir para evitar una posición
demasiado tangencial (Figura 10).
Según el estado
inflamatorio del apéndice
Figura 10: Posición de los
trocares para apendicectomía con ciego ectópico infrahepático.
Apendicitis
aguda o supurada.
Se suele observar una reacción
peritoneal con derrame turbio. Hay que tomar una muestra de este último para
examen bacteriológico. La mesa se coloca en posición proclive, de manera que el
exudado se dirija hacia el fondo de saco de Douglas. Utilizando un palpador en
T2, el apéndice turgescente y adherente se libera con delicadeza. Esta maniobra
puede facilitarse por hidrodisección. Como el apéndice es muy frágil, resulta
preferible no asirlo directamente, sino por un segmento de su meso. Éste se
coagula con la pinza bipolar y, sin exagerar la tracción, el apéndice se
secciona entre dos ligaduras. Si la inflamación es muy intensa, conviene
utilizar una grapadora lineal de 30 mm, que se introduce por un trocar T2 de 12
mm. Después de la desinfección, el apéndice se coloca dentro de una bolsa de
recolección que se retira mediante un trocar de 10 mm. Si la extracción de la
bolsa plantea problemas, puede dejarse de modo provisional dentro de la cavidad
abdominal y extraerla al terminar el procedimiento. Al final de la intervención,
con el paciente en posición proclive, se irriga con suero fisiológico. En
algunos casos está justificado dejar un drenaje exterior en T3. Si el apéndice
es muy voluminoso, la incisión umbilical o la incisión en T2 se puede agrandar
para extraer fácilmente la bolsa con los separadores de Chigot. Se administran
antibióticos de manera sistemática antes, durante y después de la operación.
Peritonitis
apendicular por perforación.
La peritonitis difusa de
origen apendicular es uno de los cuadros que mejor indica el tratamiento
laparoscópico, ya que éste permite un lavado completo de la cavidad abdominal.
Sin embargo, sólo un cirujano experimentado puede asumir esta larga y difícil
intervención. En algunos casos es razonable decidir la conversión en laparotomía.
La apendicectomía no plantea dificultades especiales, pero si el cirujano lo
juzga oportuno puede extirpar el fondo cecal con una grapadora lineal
introducida por un trocar de 12 mm en T2. Las peritonitis generalizadas pueden
requerir la instalación de otros trocares (T4 y T5) de 5 mm en los cuadrantes
abdominales superiores. Se coloca al paciente en posición proclive y se efectúa
un lavado abdominal con no menos de 5 l de líquido. Mediante la hidrodisección,
se pueden extirpar falsas membranas. Siempre se deja un drenaje (tubo de Redon)
en T3, y se administran antibióticos.
Absceso
apendicular.
Aunque un cirujano muy avezado
puede utilizar el tratamiento laparoscópico, esta intervención resulta difícil
y arriesgada a causa de la peritonitis plástica. La pared del absceso se diseca
y se abre con una pinza atraumática o un palpador en T3. Luego se aspira el pus
y se lava la cavidad en T2. Está justificado dejar un drenaje. La
apendicectomía puede efectuarse en una fase posterior.
Técnica de
apendicectomía extraabdominal («out»)
Sólo las
fases de exploración
y movilización del
apéndice se realizan
por vía laparoscópica intraperitoneal. La
ligadura del meso
y la exéresis
del apéndice se
practican en posición extraabdominal, después de haber
exteriorizado ambos elementos mediante el trocar T3 de 10 mm. Una variante
original es la apendicectomía por vía transumbilical asistida por vídeo (Begin)
[Begin, 1993. Meyer, 2004.] (Figura 11).
Figura 11: Apendicectomía
transumbilical asistida por vídeo.
A. Posición del cirujano.
B. Prensión.
C. Movilización del apéndice.
D. Extracción transumbilical del apéndice.
E. Apendicectomía extraabdominal con invaginación.
Esta técnica aprovecha dos
hechos anatómicos: que el eje del apéndice y su meso, en la posición habitual,
están orientados hacia la región umbilical, y que el conjunto cecoapendicular,
dada su movilidad, casi siempre se puede exteriorizar con facilidad mediante el
trocar umbilical. Se requiere una óptica de 10 mm con conducto operatorio. La primera
fase consiste en instalar el trocar operatorio según los principios de la
laparoscopia abierta. Luego se busca el apéndice con una pinza atraumática de
longitud adecuada (40 cm), introducida por el conducto operatorio. El intestino
se moviliza cambiando la posición del paciente y cogiéndolo con suavidad a
partir de la última asa ileal. Así, desplazando el sistema óptico-instrumental
en sentido lateral, resulta fácil desenrollar todo el intestino delgado y
explorar por completo la cavidad abdominal. Si se pasa el instrumento adecuado
por el conducto operatorio, se puede recoger material y efectuar una
aspiración. Una vez localizado el apéndice, se toma su extremo con la pinza y,
tensándolo, se evalúa la posibilidad de exteriorizarlo por el ombligo. Cuando
el meso está fijo al plano peritoneal posterior, hay que liberarlo con tijeras
o mediante coagulación monopolar, ayudándose, en caso de que sea necesario, de
un trocar T2 de 5 mm instalado en posición suprapúbica. Cuando el apéndice es
retrocecal o subseroso, también se puede despegar con las tijeras parte de la
fascia de Toldt derecha con el fin de posibilitar la movilización
cecoapendicular. Las vísceras se desplazan sólo por efecto de la gravedad, ya
que el paciente se encuentra en posición lateral. Por lo general, después de
haber tomado la extremidad del apéndice con la pinza, se logra exteriorizarlo
mediante un trocar de 10 mm. Si el apéndice es voluminoso o el meso demasiado
grueso, gracias al diseño específico de la pinza, los tejidos se pueden asir
sin riesgo de lesionarlos. En algunos casos hay que agrandar la incisión
umbilical. Luego se procede a la apendicectomía de manera convencional, en
posición extraabdominal, visualizando en todo momento la base del apéndice. Una
vez reintegrado el ciego, se instilan antibióticos y se cierra la pared
aponeurótica. La sutura del plano superficial debe ser laxa, y los planos
subcutáneos han de realizarse sin cierre cutáneo, para evitar la formación de
colecciones y celulitis. En las apendicitis agudas se puede lavar y aspirar la
cavidad peritoneal con una cánula introducida por el conducto operatorio. Tales
casos difíciles sólo pueden quedar en manos de un cirujano con gran
experiencia. Si éste considera que la intervención se vuelve demasiado
arriesgada, puede colocar uno o dos trocares suplementarios en los sitios
adecuados y seguir operando, en caso de que sea necesario, a nivel
intraabdominal. Por tanto, las primeras etapas de una apendicectomía
laparoscópica siempre se pueden realizar siguiendo los principios de la vía
transumbilical, reservándose la posibilidad de agregar otros instrumentos para
proseguir la intervención.
Apendicectomía
«mixta»
Sólo se utiliza en
determinadas apendicectomías que serían difíciles de realizar por vía
intraabdominal pura. Se colocan dos o tres trocares para explorar, localizar y
movilizar al apéndice, y para tratar el meso por vía intraperitoneal. Después
se exterioriza el apéndice a través de un trocar, y se extirpa por vía
extraabdominal.
Complicaciones [Nordestgaard,
1995. Juricic, 1994]
Pueden ser de distintos tipos,
además de las directamente imputables a la creación del neumoperitoneo.
Complicaciones
peroperatorias
La aparición de una hemorragia
que no se controla rápidamente puede justificar una conversión. Algunas son secundarias
a lesiones del pedículo epigástrico ocasionadas por los trocares T2 o T3, y
pueden controlarse mediante coagulación bipolar o por sutura transcutánea.
Otras se originan en la sección del meso, en cuyo caso hay que introducir un
aspirador en T2 y completar la hemostasia por coagulación bipolar. Los coágulos
se evacuan por lavado y aspiración. Si los intentos de hemostasia fracasan, la
conversión es obligatoria.
La ruptura
o el estallido de
un apéndice muy
patológico ocasiona una contaminación
peritoneal séptica. En estos casos hay que exteriorizar el fragmento
apendicular mediante una bolsa. Se coloca una ligadura por encima de la brecha
apendicular, y se prosigue la apendicectomía según los principios descritos,
instalando dos suturas. Se ha de buscar con mucha atención un estercolito, que
podría provocar un absceso
profundo en la
fase postoperatoria. Por
último, se realiza
una exploración completa y un
lavado con suero fisiológico, utilizando una cánula en T2 y un palpador en T3.
Complicaciones
precoces
Complicaciones
menores
Son los abscesos de pared, que
por lo general se deben a un cierre parietal demasiado hermético. Puede
formarse un hematoma.
Complicaciones
mayores
Los abscesos profundos a
menudo se originan en un estercolito apendicular abandonado al realizar la
apendicectomía. Para evitar esta complicación, siempre se debe efectuar una
doble ligadura en la base apendicular [Guillen, 2004. Horst, 2001]. Los
abscesos pueden aparecer de forma tardía, entre una semana y varios meses
después de la operación. Se debe extraer el estercolito y drenar el absceso,
suministrando antibióticos a título preventivo. Según la experiencia del
cirujano, convendrá proceder por vía laparoscópica o evacuando el fondo de saco
de Douglas por vía transrectal.
Si la exéresis no ha sido
completa, en el muñón apendicular puede persistir la apendicitis, que a veces
también se revela por una oclusión [Gordon, 2004]. Hay que intevenir de nuevo
para completar la apendicectomía. Si el muñón es demasiado corto, debe
extirparse la base cecal mediante un grapado lineal.
Tras una apendicectomía
laparoscópica, puede producirse un íleo, debido a la persistencia de un estado
inflamatorio local o a la formación de una brida que obliga a reintervenir. El
grapado lineal también puede ocasionar un íleo postoperatorio. Las grapas que
se dejan en la cavidad peritoneal tras la sección apendicular pueden ocasionar
una oclusión intestinal, por lo que se recomienda retirar las grapas
residuales, ya sea con una pinza o mediante aspiración.
Complicaciones
tardías
Se trata sobre todo de
eventraciones por orificios de trocar que han quedado abiertos [28]. Deben
cerrarse todos los orificios de 10 mm o más. Cuando el paciente presenta un
síndrome oclusivo por bridas o adherencias, puede ser necesario reintervenir
por vía laparoscópica. Sin embargo, las oclusiones tardías parecen ser menos
frecuentes tras las intervenciones por laparoscopia.
Estrategia
terapéutica y utilidad de la técnica laparoscópica
Cuando se sospecha una
apendicitis, la laparoscopia permite explorar toda la cavidad abdominopélvica y
rectificar posibles errores de diagnóstico. Esta técnica resulta muy ventajosa
en las mujeres en edad reproductiva, las personas obesas y las que desarrollan
una actividad profesional. La apendicectomía laparoscópica, hoy bien
protocolizada, sólo necesita una conversión en menos del 5% de los casos [5].
Algunos autores han propuesto respetar los apéndices normales desde el punto de
vista macroscópico, sabiendo que en el 16% de los casos existen lesiones
histológicas de apendicitis [Polliand, 2004]. Se recomienda utilizar un acceso
umbilical único con óptica separada, sobre todo cuando se trata de un niño. Si
por esta vía se logra movilizar el segmento cecoapendicular, se practica la
técnica extraabdominal. Por el contrario, si la movilización resulta imposible
a causa de la configuración anatómica del paciente, de la situación ectópica
del apéndice y/o de la existencia de lesiones infecciosas avanzadas, se instalan
uno o dos trocares complementarios para proseguir la intervención según los
principios de la apendicectomía totalmente intraabdominal. Cuando no se dispone
de la óptica específica con conducto operatorio, se escoge esta última técnica.
Puntos importantes Mediante la
exploración laparoscópica se evitan las apendicectomías innecesarias, en
especial en las mujeres jóvenes. Mediante la técnica intraabdominal con dos
trocares operatorios se puede extirpar el apéndice, con independencia de su
posición y su estado patológico. Mediante la técnica extraabdominal por
monoacceso umbilical se puede movilizar y extirpar el apéndice utilizando un
sistema óptico específico con conducto operatorio. En las apendicitis supuradas
y las peritonitis difusas, la laparoscopia brinda una enorme ventaja: la
posibilidad de irrigar ampliamente la cavidad peritoneal.
Apendicectomía por
laparotomía: conversión quirúrgica de una laparoscopia Independientemente de
una posible curva
de aprendizaje o
de la experiencia
laparoscópica del cirujano, la
tasa de conversión es del orden del 5-10% [Horst, 2001].
A continuación
se exponen las causas de la conversión.
Dificultades de
la disección Plastrón apendicular
La total imposibilidad de
individuar el apéndice en un magma inflamatorio locorregional, puede ser, para
algunos, un motivo razonable de conversión. Para otros, la apendicectomía será
diferida y se realizará después de antibioticoterapia y drenaje.
Absceso
apendicular
Según su localización (en la
fosa ilíaca derecha, retrocecal o mesocólico) su importancia, que puede
implicar a órganos vecinos, pueden justificar una laparotomía secundaria.
Peritonitis
apendiculares
La intervención por
laparoscopia es larga y difícil y requiere un cirujano entrenado, lo cual es un
argumento cuando se sopesa la posibilidad de convertir.
Anomalías de
posición
La disección de un apéndice
retrocecal subseroso o de un apéndice mesocólico pueden superar las
posibilidades de la laparoscopia, dependiendo de la experiencia del cirujano.
Una apendicectomía parcial que
no puede completarse mediante la laparoscopia exige una laparotomía.
Complicaciones
peroperatorias [Gordon, 2004]
Hemorragia
Si se produce un sangrado
arterial del pedículo apendicular tras su sección y previa coagulación, tiene
que controlarse de forma inmediata. Si no es posible, es necesario convertir
rápidamente.
Digestivas
Durante una disección
laparoscópica difícil, es posible que se provoquen lesiones de las paredes del
colon y/o el íleon en la serosa, en la seromuscular o con afectación de todo el
espesor. En función de la experiencia del cirujano, se efectuará su reparación
por laparotomía.
Conclusión
La conversión es, a priori, un
gesto necesario, sin precipitación. La localización del apéndice ya se ha
precisado durante la laparoscopia. El lugar de la incisión cutánea, la
importancia del acceso y el tipo (MacBurney, Jalaguier, vía medial
subumbilical), se eligen con más facilidad en función de la información
derivada de la laparoscopia y del motivo de la conversión.
Las modalidades técnicas de la
apendicectomía son las descritas para las apendicectomías difíciles o atípicas.
La conversión se vuelve
urgente si existe una hemorragia arterial grave del pedículo apendicular que no
se puede controlar o, excepcionalmente, por un accidente vascular importante
durante la introducción del primer trocar en caso de laparoscopia con técnica
cerrada. Un cirujano entrenado no pierde la calma y convierte rápidamente según
los criterios ya descritos.
Se exteriorizan el ciego y la
última asa ileal y se expone el meso. La hemostasia se asegura mediante
ligadura sobre un hemostático o con puntos en X con sutura de reabsorción
rápida. Se aspira la sangre acumulada. Para mayor seguridad, se coloca un
drenaje antes de cerrar.
Los factores predictivos de
conversión durante una laparoscopia son difíciles de valorar. Pueden
recordarse:
• la experiencia laparoscópica del cirujano;
• edad del paciente superior a 65 años;
• exploración física
preoperatoria que indique un síndrome
peritoneal generalizado o
un absceso apendicular;
• antecedentes quirúrgicos del enfermo;
De cualquier manera, la
conversión quirúrgica de una apendicectomía laparoscópica no tiene que verse
como un fracaso, sino como una necesidad que permite evitar complicaciones
postoperatorias. Hay que saber convertir.
Indicaciones
quirúrgicas EN PEDIATRÍA
Vía de
acceso
La introducción de las
técnicas laparoscópicas plantea hoy en día una doble pregunta con respecto a la
elección de la vía de acceso para las apendicectomías.
• ¿Facilita la laparoscopia la
intervención quirúrgica? y, si es así, ¿en qué indicaciones?
• ¿Mejora la laparoscopia el
postoperatorio?
Por lo que se refiere a la
primera pregunta, gracias a la posibilidad de acceder al conjunto de la cavidad
peritoneal, la laparoscopia permite dejar a un lado enseguida los diagnósticos
diferenciales. Por tanto, está especialmente indicada en las adolescentes, con
el fin de descartar cualquier enfermedad ginecológica. Esta facilidad de acceso
facilita más el tratamiento de las apendicitis ectópicas, subhepáticas por
ejemplo, evitando un ensanchamiento extensivo de una incisión de Mac Barney.
Por otra parte, la laparoscopia en el niño obeso resulta más fácil que una
laparotomía, debido al considerable grosor parietal.
En el niño pequeño, el lavado
de las peritonitis puede efectuarse a menudo a través de la incisión de Mac
Burney. Para evitar una incisión medial, en los niños mayores puede practicarse
de entrada una laparoscopia si el diagnóstico es preoperatorio [Daniell, 1991]
o convertir una laparotomía de Mac Burney cerrándola tras la apendicectomía y practicando
después una laparoscopia para efectuar este lavado. Hay que recordar que, por
el contrario, la conversión de una laparoscopia en laparotomía (Mac Burney o
medial) es a veces necesaria en caso de dificultad operatoria, sobre todo en
caso de síndrome oclusivo, debido a la ocupación del espacio de trabajo por la
dilatación de las asas delgadas o en presencia de un plastrón apendicular (cf
infra).
En relación con el
postoperatorio, en un estudio prospectivo aleatorizado los autores han
demostrado que la laparoscopia no modificaba la rapidez de curación o el dolor
postoperatorio tras apendicectomía en el niño [Moser, 1992]. La cuestión que se
plantea en la actualidad es la implicación de la vía de acceso, laparoscopia o
laparotomía, en la tasa de complicaciones infecciosas postoperatorias. Con
respecto a las series pediátricas, se puede considerar que los abscesos de
pared son menos frecuentes tras laparoscopia [Nottingham, 2002]. En cambio, hay
más abscesos intraperitoneales después de laparoscopia en caso apendicitis
perforada [Meyer, 2004], con una tasa en la serie de los autores del 20% frente
al 5,6% tras laparotomía (p <0,02).
Cirugía
abdominal laparoscópica durante el embarazo
Introducción
Este artículo se centra en la
cirugía abdominal y las modalidades de la anestesia en las mujeres embarazadas.
No se describirá el tratamiento del embarazo extrauterino, la cirugía fetal
intrauterina, ni las técnicas de cesárea o de hemostasia en el contexto de las
hemorragias del parto. Las principales indicaciones quirúrgicas abdominales
durante el embarazo son las enfermedades anexiales (tumor benigno o maligno,
torsión), la colecistectomía, la apendicectomía y las obstrucciones
intestinales. Existen otros casos más infrecuentes de torsión o de necrobiosis
de miomas subserosos pediculados, de hemoperitoneo por rupturas de várices
pélvicas, del bazo o del útero. Las colocaciones de catéteres ureterales tipo
doble J son frecuentes, pero no plantean problemas y rara vez necesitan una
anestesia general. La vía de acceso de elección en las embarazadas debe ser la
laparoscopia, tanto por las exigencias ergonómicas para el cirujano y por la
menor prevalencia de complicaciones parietales, como por el período más breve
de convalecencia. La técnica «sin gas» (laparoscopia sin neumoperitoneo), que
parecía prometedora en sus comienzos debido a la posibilidad de anestesia
locorregional y a la ausencia de repercusión cardiopulmonar, casi se ha
abandonado, a raíz de las dificultades de aplicación y, sobre todo, debido a la
menor calidad de la exposición. En Francia, el Collège National des
Gynécologues et Obstétriciens Français (CNGOF) ha publicado unas
recomendaciones específicas para algunos aspectos de la laparoscopia durante la
gestación. Los artículos de la literatura permiten extraer los principios
básicos que conviene conocer para emprender el tratamiento de este tipo de
afecciones.
Recomendaciones del CNGOF para
la práctica de la laparoscopia durante el embarazo.
• La laparoscopia es posible
en el primero y segundo trimestres del embarazo (grado B).
• La posición del primer
trocar de laparoscopia durante el embarazo debe adecuarse al volumen del útero
(grado B).
• A partir de las 14 semanas
de amenorrea (SA), la insuflación con aguja de Veress por vía transumbilical
está contraindicada (grado C). Se recomiendan dos técnicas de inserción de los
trocares: la laparoscopia abierta o una vía de acceso por el hipocondrio
izquierdo (grado C).
• Para una laparoscopia a
partir del segundo trimestre del embarazo, hay que colocar a la paciente en una
mesa inclinada hacia la izquierda (grado B).
• Para una laparoscopia
durante el embarazo, la presión de insuflación debe mantenerse en un valor
máximo de 12 mmHg (grado B).
• A partir de las 24 SA se
recomienda una laparoscopia abierta a nivel supraumbilical (consenso
profesional).
Peculiaridades
de la anestesia para una laparoscopia durante la gestación
La laparoscopia ha demostrado
ser una técnica inocua en el primer trimestre del embarazo e incluso en el
segundo. Los datos publicados con relación al tercer trimestre son más escasos.
Este tipo de anestesia requiere un buen conocimiento de las modificaciones
fisiológicas, anatómicas y hemodinámicas de las gestantes. El uso de CO2 para
el neumoperitoneo no expone a riesgos significativos para la madre y el feto
siempre que las presiones de insuflación se mantengan bajas durante el
procedimiento (12 mmHg). La única excepción autorizada es el momento de la
inserción de los trocares, cuando suele ser necesaria una presión temporalmente
mayor. A continuación, se recomienda usar la presión de neumoperitoneo más baja
posible para evitar la compresión de la vena cava inferior. Para una
laparoscopia a partir del segundo trimestre del embarazo, hay que colocar a la
paciente en una mesa inclinada hacia la izquierda, con el fin de minimizar la
compresión de la vena cava inferior por el útero. Puede asociarse una
compresión neumática automatizada de las pantorrillas.
Reglas de la anestesia para
una laparoscopia durante el embarazo
• Detectar una intubación
difícil en la etapa preoperatoria
• Preoxigenación antes de la
inducción
• Prevención de la hipotensión
materna:
○ expansión volémica previa
○ 15̊ de inclinación de la
mesa durante toda la intervención
○ evitar la hiperventilación
(salvo si es necesaria para mantener la oxigenación materna)
• Prevención de la neumopatía
por aspiración:
○ Control del pH gástrico
(citrato de sodio e inhibidores de la secreción ácida gástrica)
○ Vacuidad gástrica (paciente en
ayunas), vaciamiento gástrico con metoclopramida o eritromicina
• Intubación orotraqueal
• Mantenimiento de la
oxigenación materna durante la cirugía
La anestesia general con
intubación orotraqueal y ventilación controlada ya es una recomendación habitual
para la práctica de la laparoscopia quirúrgica fuera del embarazo. Esta
conducta es aún más obligatoria durante el embarazo. La alternativa de la
anestesia locorregional en esta indicación precisa sería muy discutible y hasta
claramente peligrosa, debido a la infinidad de cambios hemodinámicos y sobre
todo respiratorios inherentes a la laparoscopia y al estado gravídico. La
creación del neumoperitoneo, la mala tolerabilidad respiratoria a la
laparoscopia bajo anestesia locorregional, un bloqueo simpático extenso y la
compresión de la vena cava por el útero grávido podrían tener como consecuencia
un descenso marcado del retorno venoso y, por tanto, del gasto cardíaco, con un
riesgo de sufrimiento fetal agudo. En realidad, la tolerabilidad de la propia
laparoscopia plantearía pocas dificultades desde el punto de vista hemodinámico
materno. En los casos excepcionales en los que el riesgo de una anestesia
general pareciera desproporcionado con relación al beneficio esperado de la
laparoscopia, podría ser necesario plantear una laparotomía bajo anestesia
locorregional.
Todavía no se conocen bien los
efectos del neumoperitoneo con CO2 sobre la fisiología maternofetal. Los
estudios disponibles al respecto se refieren a modelos animales, en su mayoría
a la gestación en ovejas. El estudio de Curet et al ha aportado elementos
inquietantes con relación a los efectos de la insuflación peritoneal de CO2
sobre el equilibrio acidobásico fetal: un neumoperitoneo con CO2 a 15 mmHg
durante 30 minutos disminuiría el flujo sanguíneo uterino un 40% y provocaría
acidosis fetal . En este estudio, sin embargo, no se aplicaba una intervención
compensadora (en especial, no había una adaptación de la ventilación materna)
como suele ser habitual en la laparoscopia en el ser humano. La ventilación
mecánica solía regularse inicialmente para obtener una presión parcial
teleespiratoria de CO2 (PteCO2) de 33-38 mmHg y después no se modificaba. En
estas condiciones experimentales, la PteCO2 de la oveja aumentaba un 50% y la
presión arterial de CO2 (PaCO2) un 60% durante el neumoperitoneo, lo que
provocaba un descenso del pH fetal, paralelo a la disminución del pH materno.
Sin embargo, todas estas alteraciones intralaparoscópicas tendían a desaparecer
después de la exuflación y no parecían tener consecuencias fetales o maternas a
largo plazo. Otro estudio ofrece datos tranquilizadores: se aplicó un
neumoperitoneo de 20 mmHg durante 1 hora en ovejas gestantes y la PaCO2 se
mantuvo constante a 37 mmHg a lo largo del experimento, gracias a la adaptación
de la ventilación controlada. La única modificación fue una disminución del
flujo sanguíneo placentario materno del 40%. Los otros parámetros, como la
presión de perfusión placentaria fetal y el equilibrio acidobásico fetal, no se
afectaron. Los autores concluyeron que el feto de oveja tiene suficientes
reservas de flujo placentario para mantener intercambios gaseosos normales, a
pesar de un neumoperitoneo de 20 mmHg durante 1 hora. El trabajo de Cruz et al
ofrecer unas conclusiones similares: no se observaron efectos perjudiciales
para el feto, ni tampoco alteraciones del flujo uteroplacentario, al mantener
una PaCO2 constante gracias a la adaptación de la ventilación controlada. Con
el fin de suprimir por completo la repercusión del neumoperitoneo con CO2,
algunos autores han recomendado las laparoscopias «sin gas» con un sistema de
suspensión de la pared abdominal. Sin embargo, esta técnica se asocia a
demasiadas limitaciones en el aspecto quirúrgico (sobre todo, grandes problemas
de exposición), por lo que se ha abandonado casi del todo.
Una extensa serie
epidemiológica ha confirmado que no existen diferencias en términos de peso al
nacer, duración gestacional, crecimiento intrauterino retardado, malformaciones
congénitas y mortalidad neonatal en 2.181 pacientes embarazadas de 4-20 semanas
de amenorrea (SA) intervenidas por laparoscopia, en comparación con 1.522
pacientes sometidas a una laparotomía .
Desde el punto de vista
anestésico, la laparoscopia no plantea problemas serios durante el embarazo si
la realiza un cirujano experimentado y capaz de limitar al máximo la duración
de la intervención. Si esto es posible, hay que dar prioridad a la laparoscopia
en el segundo trimestre, con el propósito de limitar el riesgo teratógeno
potencial y teórico del uso de los productos anestésicos en el feto. La ventana
de sensibilidad máxima a los agentes teratógenos se sitúa entre las 2-7 semanas
de desarrollo para el cerebro, el corazón, los ojos y los miembros.
La técnica debe ser
relativamente simple y la existencia de dificultades intraoperatorias obligará
a evaluar de inmediato la conversión en laparotomía. Si el procedimiento
laparoscópico se prolonga (más de 60 minutos), se recomienda el uso intensivo
del control gasométrico arterial. Si la edad gestacional es avanzada (feto
viable), puede plantearse una monitorización ecocardiográfica fetal
intraoperatoria por vía transvaginal o laparoscópica.
Técnicas de
acceso laparoscópico
Principios
generales
Inicialmente, el embarazo se
consideraba una contraindicación de la laparoscopia. En la actualidad, la
mayoría de los equipos quirúrgicos ven en la laparoscopia la primera elección
en las principales indicaciones quirúrgicas abdominales durante el embarazo
(apendicectomía, colecistectomía, cirugía anexial).
Varios estudios comparativos,
aunque no aleatorizados, han demostrado que no existen diferencias de
prevalencia en términos de complicaciones después de la laparotomía y la
laparoscopia durante el embarazo, en lo referente a las tasas de abortos y de
parto prematuro. Además, como era de esperar, el tránsito intestinal se
recupera antes, la hospitalización es más corta y el dolor es menos intenso
después de una laparoscopia.
Si la intervención se puede
retrasar (lo que rara vez sucede), sería recomendable efectuarla al comienzo
del segundo trimestre. Esto no se debe a que se haya demostrado que la
laparoscopia sea más peligrosa antes, sino porque ya ha terminado la
organogénesis (lo que limita la exposición fetal a los productos anestésicos
que pueden afectarla) y porque los abortos son mucho más infrecuentes después
de las 13 SA. En el segundo trimestre no hay que esperar demasiado tiempo, pues
el aumento de volumen del útero complicará enseguida la intervención
quirúrgica.
El útero alcanza y después
rebasa el nivel del ombligo a las 20-24 SA. La posición del primer trocar
laparoscópico durante un embarazo debe adecuarse al volumen del útero. A partir
de las 14 SA, la insuflación con aguja de Veress por vía transumbilical está
contraindicada, pues se han descrito casos de lesión uterina. Por tanto, se
recomiendan dos técnicas de inserción de los trocares: la laparoscopia abierta
(por vía transumbilical o supraumbilical, según el volumen del útero) o el
acceso por el hipocondrio izquierdo (mini o microlaparoscopia). Para la
laparoscopia a partir del segundo trimestre del embarazo, hay que colocar a la
paciente en una mesa inclinada hacia la izquierda, con el fin de limitar el
riesgo de compresión de la vena cava inferior por el útero. La presión de
insuflación debe mantenerse en un nivel máximo de 12 mmHg; sin embargo, si se
usa una técnica cerrada a ciegas para realizar el neumoperitoneo y la inserción
del primer trocar, la presión intraperitoneal máxima puede subirse de forma
temporal (más de 15 mmHg). Si se efectúa una laparoscopia a partir de las 24
SA, se recomienda la laparoscopia abierta supraumbilical, aunque se han
descrito casos de acceso por el hipocondrio izquierdo en embarazos de edad
gestacional avanzada.
La colocación de los trocares
varía de una paciente a otra en función de la indicación de la laparoscopia y
de la edad gestacional, lo que lleva a menudo a disposiciones muy «exóticas» en
comparación con las ubicaciones muy sistematizadas de la cirugía pélvica fuera
del embarazo.
Técnica a ciegas (inserción a ciegas
de la aguja de Veress y del trocar transumbilical)
En teoría, al comienzo del
embarazo es posible crear el neumoperitoneo mediante la insuflación con una
aguja de Veress por vía transumbilical. Sin embargo, el rápido aumento del
volumen del útero expone de forma progresiva al riesgo de causar una lesión
uterina con la aguja de insuflación o al insertar el primer trocar a ciegas.
Los autores de este artículo consideran que hasta las 14 SA, y con la excepción
de los embarazos múltiples, es posible efectuar una técnica a ciegas para la
insuflación y la colocación del primer trocar por vía transumbilical. También
es posible insuflar el neumoperitoneo en el hipocondrio izquierdo,
introduciendo luego el primer trocar a ciegas por vía transumbilical. Si se opta
por una vía transumbilical a ciegas, la introducción del primer trocar a ciegas
se efectúa con una presión elevada (15-20 mmHg) para crear una buena
resistencia y mantener las vísceras y los grandes vasos a una distancia máxima.
Después de insertar el primer trocar, la presión intraperitoneal se disminuye a
12 mmHg. Algunos cirujanos marcan la piel a la altura del fondo uterino al
principio de la cirugía (antes de crear el neumoperitoneo), pero esta conducta
no ha sido evaluada.
Las alternativas son una vía
de acceso exclusiva en el hipocondrio izquierdo (insuflación y trocar de menos
de 5 mm) y la laparoscopia abierta. Después de las 14 SA, la palpación
abdominal permite identificar el fondo uterino (Figura 1). Los autores de este
artículo recomiendan en todos los casos una de estas dos últimas alternativas.
La técnica de inserción directa del trocar sin neumoperitoneo previo no se
recomienda durante el embarazo.
Figura 1 : Localización del fondo uterino según la edad
gestacional en un embarazo de un solo feto.
Vía de acceso en
el hipocondrio izquierdo
Aunque la inserción en el
hipocondrio izquierdo se ha evaluado poco, se le atribuye una ausencia teórica
de riesgo de insuflación accidental directa en los grandes vasos. Si hay
antecedentes de laparotomía media, la vía de acceso en el hipocondrio izquierdo
(insuflación y microlaparoscopia) es una de las alternativas recomendadas por
los autores, porque queda a distancia de las cicatrices. El punto exacto de
inserción (punto de Palmer) se encuentra sobre la línea medioclavicular (es
decir, a dos o tres dedos de la línea media), 4-5 cm por debajo de la reja
costal (tres dedos)
Se suele recomendar la
verificación previa mediante palpación de la ausencia de organomegalia (bazo,
lóbulo hepático izquierdo). Pese a que el riesgo de perforación gástrica es
pequeño, no es nulo, aunque no se ha descrito ningún caso en los 60
procedimientos incluidos en el estudio de Tulikangas et al. Algunos autores
aconsejan usar una sonda nasogástrica, pero en el estudio de Teoh et al se ha
descrito una lesión serosa gástrica (0,3%) a pesar del sondeo nasogástrico
sistemático. El eje de introducción de la aguja de Veress es perpendicular a la
piel y la posición subcostal inmediata impide la elevación parietal (Figura 4).
Durante la inserción de la
aguja de Palmer en el hipocondrio izquierdo, se advierten tres zonas de
resistencia, frente a tan sólo dos durante su inserción por vía umbilical. Los
autores de este artículo suelen usar trocares con un sistema de introducción de
dilatación radial, que permite insertar una vaina extensible gracias a la aguja
de Veress y después introducir en la vaina un dilatador romo de 5 mm. Si no, es
posible usar un trocar desechable de plástico (Figura 5) o, mejor, un trocar
metálico piramidal de 3 o 5 mm y una óptica de diámetro correspondiente (mini o
microlaparoscópica).
Figura 5 : Trocar de 5 mm desechable para la inserción
en el hipocondrio izquierdo, con una óptica de 5 mm.
El eje de introducción es
idéntico al de la aguja. Al igual que en el ombligo, hay que controlar la
profundidad de introducción. Una vez introducido el microlaparoscopio, es
posible explorar la cavidad peritoneal e introducir los trocares siguientes
bajo control visual. Las ópticas actuales de 5 mm ofrecen una calidad de visión
comparable a la de muchas ópticas de 10 mm, por lo que no es obligatoria la
inserción de un trocar de 10 mm para las laparoscopias durante el embarazo. Sin
embargo, si se inserta un trocar de 10 mm, se debe introducir bajo control
visual (con la óptica de 3 o 5 mm insertada en el hipocondrio izquierdo),
situándolo a nivel supraumbilical (más o menos alto según la edad gestacional).
Los trocares laterales también se colocan a menudo más arriba de lo habitual,
es decir, muy por encima del nivel de las espinas ilíacas anterosuperiores.
Para las laparoscopias a una edad gestacional avanzada, es frecuente tener que
colocar el trocar óptico y los trocares anexos en el mismo lado, de modo que la
óptica y los instrumentos no crucen el fondo uterino.
Laparoscopia
abierta durante el embarazo
Esta técnica (descrita
inicialmente por Hasson) consiste en insertar el primer trocar, sin insuflación
previa, bajo control visual directo por una incisión parietal. La laparoscopia
abierta puede efectuarse en cualquier sitio de la pared abdominal, pero la
localización preferente se sitúa sobre la línea alba (punto de unión de las
aponeurosis anterior y posterior de los músculos rectos del abdomen), bien a
través del ombligo o a nivel infraumbilical. Se han descrito diversas técnicas
de laparoscopia abierta, pero las principales son la vía intraumbilical
(transumbilical) y la vía infraumbilical. En el acceso intraumbilical, se
realiza una incisión cutánea semicircular en el ombligo. Incluso si el diámetro
del trocar es de 10 mm, la incisión cutánea debe ser mayor, de unos 15 mm. La
exposición mediante separadores de Farabeuf (a menudo se requieren varios
tamaños) y la disección de los tejidos subcutáneos permiten la identificación y
sección de la aponeurosis de los músculos rectos, que se abre mediante la
separación de unas tijeras introducidas por la incisión inicial o con bisturí
frío, después de sujetar y traccionar los bordes de la aponeurosis con pinzas
de Kocher. A continuación, los separadores se introducen en la abertura
aponeurótica; el movimiento de los dos separadores permite exponer el peritoneo
parietal anterior, que se tracciona y se secciona con bisturí frío o tijeras.
No se recomienda practicar una incisión con bisturí eléctrico, ni incluso
efectuar una coagulación preventiva del peritoneo antes de abrirlo, pues puede
haber un asa de intestino delgado justo debajo. También hay que procurar no
sujetar un asa digestiva al efectuar la tracción peritoneal. Una vez verificada
la abertura peritoneal, se inserta el trocar óptico de 10 mm (o mayor si fuera
necesario).
Algunos de los trocares
ópticos son específicos para esta vía de acceso abierto y poseen un sistema
integrado de hermeticidad (balón inflable con una abrazadera). Si no se dispone
de estos trocares, a menudo es necesario confeccionar una bolsa de tabaco
hermética alrededor de la abertura peritoneal y ajustarla al trocar. Después de
colocar el primer trocar, se crea el neumoperitoneo. Para la técnica abierta
infraumbilical, la incisión cutánea es vertical infraumbilical. El principio
consiste en acceder al tracto umbilical central fibroso y así conseguir un
acceso rápido a la cavidad peritoneal. Después de la incisión cutánea, se
introducen los separadores de Farabeuf y la parte posterior del ombligo se
sujeta con una pinza de Kocher. Se tracciona del tejido fibroso en sentido
vertical y se corta con tijeras de Mayo curvas, continuando la sección hasta
entrar en la cavidad peritoneal.
Cualquiera de estas técnicas
puede aplicarse en el primer trimestre del embarazo. Después, habrá que
efectuar un acceso abierto por encima del fondo uterino. La incisión cutánea
vertical en la línea media es de unos 15 mm. La técnica de acceso al peritoneo
es comparable a la de la vía transumbilical.
Con esta técnica abierta, se
reduce de modo ostensible el riesgo de lesionar los grandes vasos, así como el
riesgo de lesión uterina en las gestantes. Sin embargo, sobre todo en las
mujeres muy delgadas, el riesgo no es nulo si la incisión con el bisturí frío
es demasiado profunda, por lo que ésta debe ser estrictamente cutánea. Además,
la prevalencia de las heridas digestivas aumenta de manera significativa en las
laparoscopias abiertas.
Bibliografìa
• Ashcraft. Cirugia pediátrica.
Mc Graw hill.
• Begin, 1993. Création du
pneumopéritoine sous contrôle visuel Begin GF.. J Coelio-Chir 1993;5:18-20.
• Begin, 1993. L'appendicectomie chez l'enfant par mono-abord
coelioscopique Begin G.F. Chir. Endosc. 1993 ;
2 : 6-9
• Brunicardi. Schwartz, Principios de cirugía. 9na. Edición. Mc
Graw Hill.
• Carico. Atlas tratamiento quirúrgico del trauma. Mc Graw Hill.
• Champault, 1997.
Recognition of a pathological appendix during laparoscopy: a prospective
study of 81 cases Champault G., Taffinder N., Ziol M., Rizk N., Catheline J.M.
Br. J. Surg. 1997 ; 84 : 671 [cross-ref]
• CMCG. Tratado de cirugía general. 2da. edición. Manual moderno
• Cunningham. Williams obstetricia. Panamericana.
• Daniell, 1991. The use of an automatic stapling device for
laparoscopic appendectomy Daniell J., Gurley L., Kurtz B., Chambers J Obstet.
Gynecol. 1991 ; 78 : 721-723
• De Wilde R.L. Goodbye to late bowel obstruction after
appendicectomy Lancet 1991 ; 338 : 1012
[cross-ref]
• Diaz rubio. Transtornos motores del aparato digestivo. Panamericana.
• El Ghoneimi, 1994. Laparoscopic appendectomy in children: report
of 1379 cases El Ghoneimi A., Valla J.S.,
Limonne B., Valla V., Montupet P.,
Chavrier Y., y al. J.
Pediatr. Surg. 1994 ; 29 : 786-789
[cross-ref]
• Elsevier 2014. Tratado de
Cirugía del aparato digestivo.
• Elsevier 2014. Tratado de
Cirugía plástica.
• Elsevier 2014. Tratado de Cirugía General.
• Elsevier 2014. Tratado de Ginecología y obstetricia.
• Elsevier 2014. Tratado de Medicina.
• Elsevier 2014. Tratado de Pediatría.
• Elsevier tratado de Urología, 2014.
• Gleicher. Tratamiento de las complicaciones clínicas del
embarazo. Panamericana
• Gliedman. Atlas de técnicas quirúrgicas. Mc Graw Hill.
• Goldberg. Fundamentos de cirugía anorectal. Noriega Limosa.
• Gordon, 2004. Residual
appendix producing small-bowel obstruction after laparoscopic appendectomy
Gordon R., Bamehriz F., Birch D.W. Can. J. Surg. 2004 ; 47 : 217-218
• Guillen, 2004. Retrained
appendicolith after laparoscopic appendectomy: the need for systematic double
ligature of appendiceal base Guillem P., Mulliez E., Proye C., Pattou F. Surg.
Endosc. 2004 ; 18 : 717-718 [cross-ref]
• Guller, 2004.
Laparoscopic appendectomy in the elderly Guller U., Jain N., Peterson E.D., Muhlbaier L.H., Eubanks S., Pietrobon . Surgery 2004 ; 135 : 479-488 [cross-ref]
• Gutiérrez Samperio. Fisiopatología quirúrgica del aparato
digestivo. 2da. edición. Manual Moderno.
• Hinman. Atlas de cirugía urológica. Mc Graw Hill.
• Horst, 2001. Postappendectomy abscess: the role of fecoliths
Swiss Horst M., Eich G., Sacher P. Surg. 2001 ;
7: 205-208
• Ikeda, 2004. Laparoscopic
versus open appendectomy in
children with uncomplicated and complicated appendicitis Ikeda H., Ishimaru Y.,
Takayasu H., Okamura K., Kisaki Y.,
Fujino J. J. Pediatr. Surg. 2004
; 39 : 1680-1685 [cross-ref]
• Juricic, 1994. Laparoscopic appendicectomy: case reports of
vascular injury in 2 children Juricic M., Bossavj J.P., Izard P., Cuq P.,
Vaysse P., Juskiewenski S. Eur. J. Pediatr. Surg. 1994 ; 4 : 327-328 [cross-ref]
• Khan, 2003. Open laparoscopic access for primary trocar using
modified Hassons technique Khan A.R. Saudi Med. J. 2003 ; 24 : S21-S24 [cross-ref]
• Lal, 2004. Open port
placement of the first laparoscopic port: a safe technique Lal P., Singh L.,
Agarwal P.N., Kant R. JSLS 2004 ; 8 : 364-366
• Lee, 2003. Laparoscopic appendectomy versus open appendectomy in children:
another opinion Lee C.H. Lin
YL. Int. Surg. 2003 ; 88 : 92-94
[cross-ref]
• Liu, 2002. Factors associated with conversion to laparotomy in
patients undergoing laparoscopic appendectomy Liu S.I., Sievert B., Raptopoulos
V., Hodin R.A. J. Am. Coll. Surg. 2002 ; 194 : 298-305 [cross- ref]
• Madden. Atlas de técnicas
en cirugía.
• Maingot-Zinner. Operaciones abdominales. 11 va. edición Panamericana.
• Mattox. Trauma. Mc Graw hill.
• Mayagoitia. Hernias de la pared abdominal. 2da. edición. Mc Graw Hill.
• Meyer, 2004. Meyer A., Transumbilical laparoscopic-assisted “one-
trocar” appendectomy. TULAA. as an alternative operation method in the
treatment of appendicitis Preuss M., Roesler S., Lainka M., Omlor G. Zentralbl.
Chir. 2004 ; 129 : 391-395 [cross-ref]
• Michael Henry. Cirugia clínica. Masson.
• Misiewicz. Atlas de gastroenterología clinica. Mossby.
• Montupet, 1993. Acute
appendicitis and appendiceal
peritonitis in children.Montupet P.,
Alain J.L., Chavrier Y., Limone B.,
Valla J.S., Varlet F. Coelioscopic treatment Chirurgie 1993 ; 119
: 443-445
• Moser, 1992. . Laparoskopishe Appendektomie mit dem
Multi-Fire-Endo-GIA Moser K.H., Schmitz R Chirurg 1992 ; 63 : 393-395
• Msika, 1999. Comment
réduire les appendicectomies inutiles Msika S. J. Chir. (Paris) 1999 ; 139 : 299-300
• Noble, 2003. Who is doing
laparoscopic
appendicectomies and who taught them?Noble H., Gallagher P.,
Campbell W.B. Ann. R. Coll. Surg.
Engl. 2003 ; 85 : 331-333 [cross-ref]
• Nordestgaard, 1995. Major
vascular injuries during laparoscopic procedures Nordestgaard A.G., Bodily
K.C., Osborne R.W., Buttorff J.D. Am. J. Surg. 1995 ; 169 : 543-545 [cross-ref]
• Nottingham, 2002. Mechanical small bowel obstruction from a
loose lineair cutter staple after laparoscopic appendectomy Nottingham J.M.
Surg. Laparosc. Endos Percutan Techn. 2002 ; 12 : 289-290 [cross- ref]
• Nyhus. Dolor abdominal. Editorial paramericana
• O´Neil. Pediatric surgery. Mosby.
• Perera. Cirugía de
urgencia. 2da. edición. Interamericana.
• Polliand, 2004.
Faut-il opérer les appendicites aiguës
par laparoscopique? Polliand C.,
Bayeh P.J., Barrat C., Champault G.
J Coelio-Chir. 2004 ; 51 : 17-23
• Quintero. Infeccion en cirugía. Editoral panamericana
• Rock. Te Linde. Ginecologia quirúrgica. Panamericana
• Sabiston. Atlas de cirugía. Mc Graw Hill.
• Sabiston. Tratado de cirugía. Mac Graw Hill
• Sartori, 2004. Principes
généraux sur le positionnement des trocarts
en chirurgie laparoscopique :
« La philosophie
du placement des
trocarts Sartori C.A., Dal Pozzo
A., Franzato B., Balduino M. J.
Coelio-Chir 2004 ; 51 : 40-47
• Sauerland, 2004. Laparoscopic
versus open surgery
for suspected appendicitis
Sauerland S., Lefering R., Neugebauer E. Cochrane Database Syst Rev 2004 ; 4 : (CD001546).
• Skandalakis. Hernias. Mc Graw Hill.
• Skandalakys. Complicaciones anatómicas en cirugía general. Mc
Graw Hill.
• Steyaert, 1999. Laparoscopic appendectomy in children: sense or
nonsense?Steyaert H., Hendrice C., Lereau L., Hayem
C., El Ghoneimi
A., Valla .S. Acta Chir. Belg. 1999 ; 99 : 119-124
• Suros. Semiologia medica y técnica exploratoria. Masson.
• Testut-Latarget. Anatomía Humana. Salvat.
• Van der Voort, 2004. Bowel injuy as a complication of
laparoscopy. Van Der Voort M, Heijnsdijk EA, Gouma DJ. Br J Surg 2004; 91:
1253-8.
• Wolfe. Terapeutica de los trnstornos digestivos. Mc Graw Hill.
• Zuidema-Shackelford.
Cirugía del aparato digestivo. 6ta edición. Interamericana.


























No hay comentarios.:
Publicar un comentario